2024.07.19
メディケア(米国の保険制度)患者を対象とした遡及的研究によると、乳がんを患う高齢女性に対するホルモン療法を施行した場合、その後のその患者さんの認知症リスクの低減と関連していることが示唆されました。サウスカロライナ大学コロンビア校のチャオ・カイ博士らがJAMAネットワークオープンで報告しています。Cai C, Strickland K, Knudsen S, Tucker SB, Chidrala CS, Modugno F: Alzheimer Disease and Related Dementia Following Hormone-Modulating Therapy in Patients With Breast Cancer. JAMA Network Open 2024, 7(7):e2422493.
ホルモン療法を受けた乳がん患者は、ホルモン療法を受けなかった患者と比較して、平均12年間の追跡期間中に認知症のリスクが7%低かったとのこと。(HR 0.93、95%CI 0.88-0.98、P =0.005)しかしその効果は年齢によって反対の効果にもなっていたようです。
認知症のリスク低下は、65~69歳の乳がん患者群で最も顕著に認められました(HR 0.48、95% CI 0.43~0.53)。しかしこの関連性は加齢とともに減少しました。
80歳になると、ホルモン療法の使用は認知症リスクとの正の関連性に移行し(HR 1.40、95% CI 1.29~1.53)、90歳以降までその傾向が続きました。
またこの効果は人種によっても異なる結果になっており、ホルモン療法を受けた65~74歳の黒人乳がん患者では、相対リスクが24%減少しました(HR 0.76、95% CI 0.62~0.92)。同じ年齢層の白人乳がん患者では、相対リスクが11%減少しました(HR 0.89、95% CI 0.81~0.97)。
「ホルモン治療のような特定の治療法から、認知症リスクの低減という恩恵を受ける可能性のあるのは、特定の一群であり、全員には当てはまらない」と、Cai氏は語っています。「結果を最適化し、リスクを最小限に抑えるためには、患者の年齢や人種などの個人的要因を考慮するべきである。」

薬剤ごとの認知症への影響も、人種によって異なるようです。
65~74 歳の黒人女性の場合、アロマターゼ阻害剤の使用は、SERM(タモキシフェンなど)(HR 0.80、95% CI 0.57~1.11)よりもわずかに強い関連性を示しました(HR 0.73、95% CI 0.59~0.91)が、SERMに関する知見は有意ではなかった。
65~74 歳の白人女性では、SERMによりリスクが有意に減少しました(HR 0.81、95% CI 0.70~0.94)。
多くの乳がんはホルモン受容体陽性で、エストロゲン(女性ホルモン)ががん細胞の増殖に及ぼす影響を阻止するためにホルモン療法で治療されています。ホルモン療法は乳がんの生存率を高める可能性があるが、認知機能の低下との関連も報告されていると、カイ氏と共著者らは指摘しました。過去の研究では、ホルモン療法との関連はないという反対の結果もあり、逆にホン論文のようにホルモン療法による予防効果があるとするもの、または認知症リスクの増加が示されたなど、一定した結果は出ていませんでした。
話はそう単純ではないようです。
Chai氏らは、がん登録データとメディケア請求を組み合わせた監視、疫学、SEERとメディケアの連携データベースを使用して、2007年から2009年の間に新たに乳がんと診断された65歳以上の女性を特定してかいせきしました。認知症の既往歴がある患者や、乳がんの診断前にホルモン調節療法を受けていた患者は除外しています。彼らは、がん治療のためにホルモン療法を受けた女性と受けなかった女性を比較し、乳がんの診断から2019年末まで最低10年間追跡調査しました。ホルモン療法を受けているかどうか、の定義に関しては乳がんの初回診断から3年以内に、タモキシフェンなどのSERM、アロマターゼ阻害剤、ゾラデックスなどの選択的エストロゲン受容体分解薬など、少なくとも1種類のホルモン調節薬の投与を開始したことと定義しました。合計で 18,808 人の女性がこの研究に含まれ、そのうち 65.7% がホルモン療法を受けていました。最も一般的な年齢層は 75 ~ 79 歳で、女性の 80% 以上が白人、約 7% が黒人でした。ほとんどの女性 (76.1%) がアロマターゼ阻害剤によるホルモン療法を開始していました。
衝撃的な内容だったので、ここで紹介しました。ホルモン療法と認知症リスクには何らかの関係がありそうではあるのですが、実際の治療で認知症リスク改善を狙って投与することは時期尚早でしょう。そもそも人種ごとに差があると書いているのに、アジア系の人の調査は行われていません。
ホルモン剤が投与されていない乳がん患者さんはトリプルネガティブ乳がんが、HER2エンリッチ乳がん症例のはずです。投与されているひとはルミナールタイプです。こうした乳がんのサブタイプごとの発生リスクと遺伝の関係は絶対ではありませんが、0ではありません。ホルモン剤が直接認知症を抑えているのではなくて、ルミナールタイプの乳がんになりやすい遺伝子を持った方が認知症になりにくいのかもしれません。またホルモン剤を投与されている方は投与されていない方よりもどうしても医療機関を受診する機会が増えます。そのため高血圧や、糖尿病など、認知症リスクに直結する疾患が早く見つかり、治療されているからなのかもしれません。
ホルモン療法と認知症に関するさまざまな研究は以前から行われているようです。しかしこういうテーマで研究を行う場合、遡及的研究(いままでの過去の症例をさかのぼって検索すること)設計では、なかなか思うような結果には至らないことが多いのが現実です。
あえて認知症の発症に研究対象を絞って、健康な人を、ホルモン剤を投与した群としなかった群に分けて調査する必要があります。それだと本来ホルモン剤が必要でもなんでもない人に何年も投与することになってしまうことを考えると、真の答えを見つけるのは難しいかもしれません。
2024.06.01
乳がん検診において、マンモグラフィにおける乳房濃度は4段階に分けられます。特に高濃度乳腺や不均一高濃度乳腺とされた方は注意が必要とされます。乳腺の濃度はそれが上昇するにしたがって、乳がんの発生を増加させ、マンモグラフィの感度を相乗的に低下させる強力なリスク要因です。
また、がんでもないのにがんが疑わしいとされる偽陽性の発生がよく起こるため、精査をするように勧められたり、それによる追加検査、診断の遅れや、最終的には当てにならないとされて受診控えにつながるなど、医療費の増加にもつながります。
これらのことから、最近ではマンモグラフィ検診を受けられた方にはその乳腺濃度を通知することがほぼ義務付けられており、乳腺濃度に対する皆さんや医療提供者の関心の高まりにつながっています。しかし、乳がんの他のリスク要因とは異なり、乳腺の濃度は女性の生涯を通じて動的であり、修正可能です。
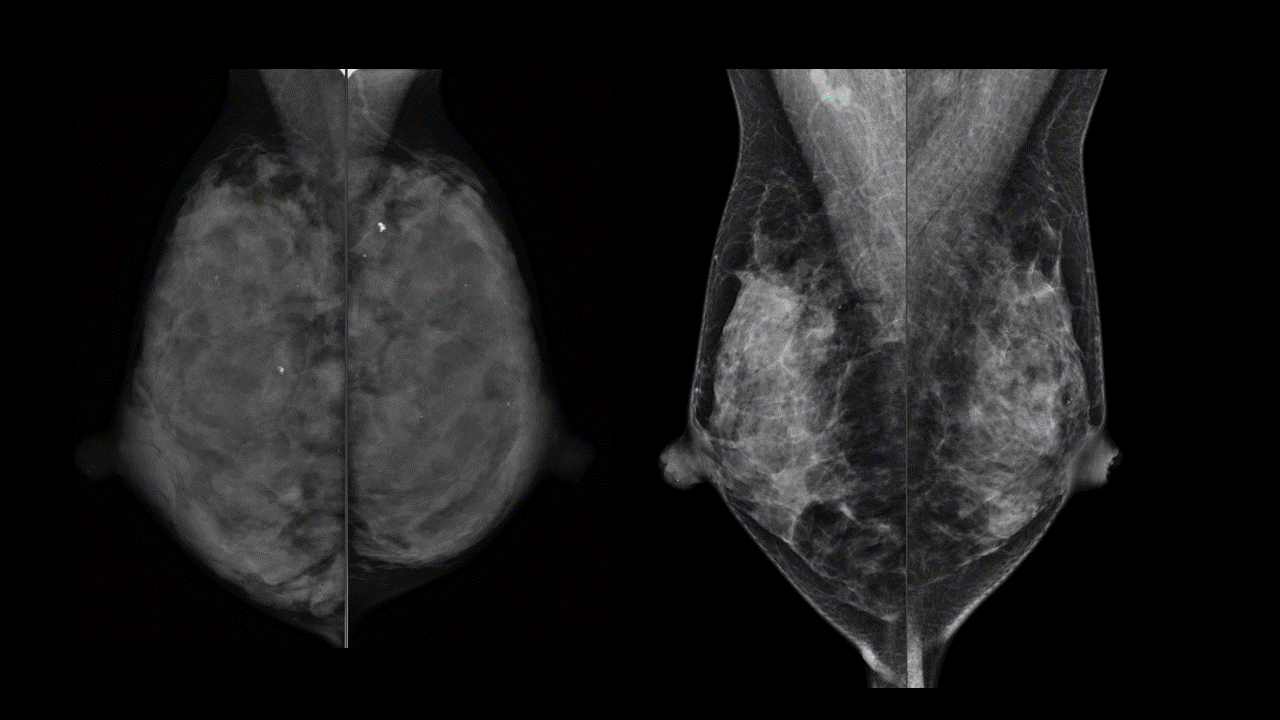
たとえばこのマンモグラフィは左右とも同じ型です。
左側は4年前に取られたもので、右側が現在です。乳腺のぎっしり詰まった感じがずいぶん痩せて、抜けてきたように思います。高濃度乳腺から不均一高濃度乳腺に変化しています。この方は左側の撮影時には33歳、右は38歳です。ここまでの変化は加齢だけでは起こりません。
この方はこの4年間で一人目のお子さんを授かり、1年近く完全母乳で授乳経験をされていました。
これまでもこのブログでは乳腺の濃度について何度も触れてきました。
高濃度乳腺とは ーAre You Dense?ー
”ブレスト・アウェアネス”という考え方
高濃度乳腺の乳がんリスクについて
”高濃度乳腺は乳がんリスクが高い”ことを知っていますか?
もしまだ読んでおられない方があればまずここから読まれることをお勧めします。
何度も触れてきたように、乳腺濃度は高ければ高いだけ、乳がんが発生するリスクが高まり、それでいてマンモグラフィ検診での発見が難しくなるため不利になります。
ただこの乳腺濃度は生涯一定ではなく、様々な要素で変化するのです。先に述べた授乳経験もその一つです。ただこれはだからと言ってそうするわけにはいきません。なにか現実的に実行可能な方法で乳腺濃度を”修正”できないか? それができるとする論文を見つけたので紹介させていただきます。
Lester SP, Kaur AS, Vegunta S. Association Between Lifestyle Changes, Mammographic Breast Density, and Breast Cancer. Oncologist. 2022; 27: 548-54.
Lester先生による論文を紐解きながら、これについて述べていきます。

女性の生涯を通じて乳房組織には大きな変化が起こります。思春期には乳腺が拡大・発達し、月経がはじまるとその周期に応じて増殖・退縮を繰り返します。授乳期には腺組織(ミルクを作る組織)と乳管(それを乳頭まで運ぶ管)が大きく変化します。閉経後は脂肪沈着や退縮が起こり、当然乳腺の濃度も変化します。
したがってその行動パターンによって乳腺濃度は生涯をかけて修正できる可能性があります。
乳腺の濃度が乳がんの独立した危険因子であるということは、大規模コホート研究、症例対照研究、および人口ベースの研究で証明されています。
乳腺濃度が高濃度乳腺である女性は、乳腺濃度が脂肪性乳腺の女性よりも、乳がんが発症する可能性が4 ~ 6 倍高くなります。乳がんの治療で使用される、女性ホルモンを抑制する薬剤、アロマターゼ阻害薬療法や選択的エストロゲン受容体遮断薬などを使用して、乳腺濃度を下げる治療をすれば乳がんそのもののリスクもさげることが知られていますが、これら薬剤を生涯にわたって継続的に使用することは現実的ではありません。
マンモグラフィ上で本来の正常な乳腺の組織と等密度である小さな乳房病変が、高濃度乳房組織によって隠されてしまう状況はしばしば発生しており、これが高濃度乳腺では乳がんの小腫瘤が発見できない大きな理由になります。つまりコントラストがなくなってしまうのです。(”雪原の雪ウサギ”、”闇夜の烏現象”です)
これにより、高濃度乳房の患者さんのマンモグラフィによる検診は大変難しくなります。小さな乳腺腫瘍が見落とされ、リンパ節転移を伴うようなより大きな腫瘍になるまで発見されなかったり、結果として生存率の低下につながる可能性があります。
マンモグラフィの全体的な感度(がんを見つける力、がんの症例が100例あればそのうち何例見つけられるか)は70 %~90%とされます。
脂肪性乳腺の乳房濃度の女性では感度は 80%~98% ですが、高濃度乳腺の乳房濃度の女性では感度が 30%~48% まで低下することがあります。しかし乳腺濃度を落とせばこうしたマスキング効果が減少し、マンモグラムの感度が向上し、早期診断が容易になります。
乳腺濃度は、授乳経験をすれば下がります。また乳がんで使われる女性ホルモンを抑制する薬を使えば下がります。しかしそれは現実的ではありません。
では実行可能な方法として、乳腺濃度を下げるにはどのような方法がある、とLester先生は言われるのでしょうか?
70,000人以上の参加者を対象とした複数の研究の体系的レビューによって、乳腺濃度の増加がアルコール摂取と関連していることが判明しました。これはなぜなのでしょうか。現在予想されているメカニズムは、アルコール摂取によりエストロゲン(女性ホルモン)産生とアロマターゼ酵素活性の増加が起こることが原因とされています。これによりアンドロゲンからエストロゲンへの末梢変換が促進され、エストロゲンレベルの上昇が引き起こされます。アルコールはインスリン成長因子とインスリン様成長因子も増加させます。これらは乳腺上皮細胞の増殖を引き起こし、エストロゲンと相乗的に作用して乳腺濃度の上昇につながります。
閉経前および閉経後の女性 424 名を対象とした研究では、1 日あたり 10 g を超えるアルコール摂取 (ワイン 250 mL あたり 25 g、ビール 300 mL あたり 12 g、蒸留酒 20 mL あたり 6.2 g) が乳腺濃度の上昇と関連していました。
閉経前および閉経後の女性 1508 名を対象としたミネソタ乳がん家族コホート研究では、1 日のアルコール摂取量が 3.9 g 以下の女性では、飲酒しない女性と比較して 乳腺濃度が上昇していました(p=0.08)。
乳房密度が高い女性 497 人と乳房密度が低い女性 288 人を対象とした研究では、大量飲酒者 (1 週間に 140 g 以上) に分類された女性と非飲酒者に分類された女性を比較したところ、飲酒量が増えるにつれて乳房密度が有意に上昇していました(p=0.09) (オッズ比 [OR]、2.1、95% CI、1.2-3.9、P=0.01)。
同様に、約 2000 人のヨーロッパ人女性を対象とした研究では、飲酒量と乳房密度の増加の間に正の相関関係が示されました(p=0.01)。
25 5356 人の女性を対象とした大規模コホート研究であるデンマークの食事、がん、および健康研究では、週に 7 杯以上飲む 20-29 歳の女性では乳腺の濃度が高く、特に飲み物が蒸留酒の場合にその傾向が強い傾向が見られました (OR、1.31、95% CI、1.00-1.72)。
ただ飲酒量の多い女性では、たとえば肥満しやすい、あるいは塩分摂取量が多いなど、他にも関連する要素が存在するので、アルコールそのものが乳腺濃度を上昇させているのか、については今後の研究を俟たないと結論は出ないと思います。
アルコールは乳がん、特にエストロゲン受容体陽性がんの既知の危険因子であり、アルコールは閉経前および閉経後の女性のMBDを増加させます。25、26 MBDの増加は発がん性のメカニズムである可能性があります。
まとめ1
・アルコール摂取は、乳腺濃度を上昇させる効果がある可能性があります。
・・・・・・・・・・・・・・・・・・・長くなりそうなので、第2回に続きます。
2024.03.22
米国臨床腫瘍学会(ASCO)は、2024年に成人がん患者へのワクチン接種に関するガイドラインを発表しました。
そこではわたしのような臨床医が化学治療をされている患者さんにガイドラインで推奨されているような抗がん剤治療を実施する際に、患者さんから受ける可能性のある重要な質問のいくつかに対処します(下の図、英語ですがあとから解説します)。
感染症に対するワクチン接種は、がん治療を受けている人にとって重要な予防策です。
逆に医師にとって、がんと診断された患者さんを、ワクチンで予防可能な病気から確実に守るための早期の措置を講じることは、重要かつ優れた処置と言えるでしょう。

カッコ内は筆者注
がん治療を受けている人は(その多くが化学治療や栄養不良などで免疫がおちているため)、ワクチンで予防できる特定の病気による重篤な結果に対してより脆弱です。これらの病気に対する予防接種を積極的に行うことは、感染性合併症から身を守り、もしかすると最終的にがん関連の転帰に影響を与える可能性のある治療の遅れの発生を避けるために重要です。
がん治療を受けている成人は、推奨されているすべてのワクチンを受けることが勧められます。肺炎による入院は、がん治療で最も一般的な感染性合併症の一つですが、ワクチンによってその重篤度は軽減されます。したがって、患者は肺炎球菌ワクチンと、インフルエンザ、RS ウイルス (RSV)、新型コロナウイルス感染症 (COVID-19) を含む季節性呼吸器ワクチンを引き続き接種する必要があります。成人では年齢に関係なく、がんの診断後に帯状疱疹のリスクが高まります。したがって、19 歳以上の患者は、帯状疱疹とそれに関連する合併症を予防するために、組換え帯状疱疹ワクチン (RZV) を受ける必要があります。 B 型肝炎ワクチンは、これまで予防接種を受けたことのない 19 ~ 59 歳のすべての成人に推奨されます。同様に、破傷風、ジフテリア、および無細胞百日咳ワクチン (Tdap) は広く推奨されているワクチンであり、患者には最新のワクチンを入手するよう奨励する必要があります。最後に、ヒトパピローマウイルス (HPV) ワクチンは、45 歳未満の成人の感染予防に重要です。
先に示したような推奨されているワクチンは、患者の免疫系ががん治療によって影響を受ける前に可能な限り最大限の防御を達成するため、がん治療を開始する前に投与することが理想的です。
インフルエンザ、RS ウイルス、および COVID-19 のワクチンは、これらのウイルスが地域的に一時的に広がる前に接種を受ける必要があります。国は、秋冬シーズン中にワクチンの状態を定期的に評価し施行する施策を行っていますが、これによってワクチン接種へのアクセスは容易になり、人々を教育し、健康状態や感染状況を改善するための重要な機会を提供しています。こうした季節性ワクチンは、化学療法、免疫療法、または放射線治療と同時に投与できます。治療中であり、白血球減少症や貧血がある場合に予防接種を避けるようとしてインフルエンザワクチンの接種時期を変更することはお勧めできません。明らかな利益が得られずに予防接種の機会を逃してしまう可能性があります。(たとえば組換え帯状疱疹ワクチンは19歳以上の方に少なくとも4週間の間隔をあけて2回接種ですが最初の1階を投与後に化学治療を施行し、白血球が下がっていたとしても)ワクチン接種が開始されたら、残りのワクチン接種を完了してからがん治療を開始するなどして遅らせてはいけません。
継続的ながん治療中であっても、感染防御を最大とするために、複数回投与しなければいけないワクチン投与のスケジュールを工夫することができます。
たとえば、RS ウイルス の 2 回目の投与は、推奨されている 2 ~ 6 か月の投与間隔ではなく、4 週間後に行うことができます。
下に示した表の B 型肝炎ワクチンのスケジュールには、免疫不全患者の免疫反応を改善するためのより高い抗原と追加用量が含まれています。さらに、臨床予防に必要な抗体レベルが満たされていない場合は(ワクチンを接種しても免疫がついていないと検査で判明した際には)、再ワクチン接種の必要性を評価するために、シリーズ終了後にB型肝炎抗体レベルをチェックする必要があります。
新型コロナウイルス感染症(COVID-19)ワクチンの接種は、ワクチンを接種しても免疫がつかないことが予想される、抗がん剤治療を受けている人に対して、2か月間隔で繰り返すことができ、ウイルスの市中流行がリスクになっている場合には強く検討されるべきです。
同種移植および自家移植のレシピエント(急性白血病などの疾患によって骨髄移植を受けなければならなくなった患者さん)は、小児期や移植前に接種していた過去のワクチン接種でついていた免疫を失うため、再免疫を受ける必要があります。
細胞除去療法(特定の白血球を除去する治療法)やキメラ抗原受容体T細胞治療(特定の白血球や免疫を就職する治療)を受けている特定の患者も、一部のワクチンによる再免疫から恩恵を受けることができ、これらの推奨事項はガイドラインでも取り上げられています。
| ワクチン | 推奨年齢 | スケジュール |
|---|---|---|
| インフルエンザ | 全年齢 | 毎年 |
| RSウィルス | 60歳以上 | 1度 |
| COVID-19 | 全年齢 | 行政の指針に従う |
| Tdap (破傷風、ジフテリア、無細胞百日咳) | 19歳以上 | Tdap を 1 回投与し、その後 10 年ごとにTd または Tdap ブースターを投与 |
| B型肝炎 | 19~59歳:対象 60歳以上:他の危険因子を持つ人は予防接種を受ける | 20歳以上の成人の場合、高抗原(40μg)を使用し、Recombivax HBシリーズを3回投与(0、1、6ヶ月)またはEngerix-Bシリーズを4回投与(0、1、2、6ヶ月)として投与します。 |
| 組換え帯状疱疹ワクチン | 19歳以上 | 少なくとも4週間の間隔をあけて2回接種 |
| 肺炎球菌ワクチン | 19歳以上 | PCV15 を 1 回投与、8 週間後に PPSV23 を投与、またはPCV20 を 1 回投与 |
| HPV | 19~26歳:対象 27~45歳:共有意思決定 | 3回接種、0、1~2、6か月 |

制御不能で重篤な感染症が発生する潜在的なリスクがあるため、がん患者への生ワクチンの接種は避けましょう。
米国の小児および成人で日常的に使用されている生ワクチンの例には、水痘、おたふく風邪、麻疹、風疹(MMR)および弱毒化インフルエンザ生ワクチン(LAIV)が含まれます。
現在米国で認可されている帯状疱疹ワクチンは非生ワクチン(RZV)であり、がん治療を受けている人に安全に投与できます(日本では、帯状疱疹の予防接種として「生ワクチン」と「不活化ワクチン」の2種類のワクチンが使われています。 帯状疱疹の予防接種を受けるときは、接種対象者や、接種する回数・接種にかかる費用などの情報を確認したうえでご自身の状況に合うワクチンを選ぶことが大切です。)。
以前の帯状疱疹ワクチンは生ウイルス製剤でしたが、2020 年以降米国では利用できなくなりました。がんと診断される前に生ワクチンを受けていた可能性がある人は、引き続き非生帯状疱疹ワクチンを受ける必要があります。現在認可されている非生ワクチンはすべて、がん患者にとって安全です(これはがん患者さんに対してであり、決して生ワクチンそのものが危険というものではありません)
(現在がん治療においては免疫チェックポイント阻害剤(ICI)が使用されています。こうした薬剤の使用によって)免疫関連の有害事象が悪化する可能性があるため、インフルエンザワクチンや新型コロナウイルス感染症ワクチンと、免疫チェックポイント阻害剤(ICI)の併用は危険ではないか、という考え方もありますが、そのこと自体 危険とは証明されていません。よって現状どちらのワクチンも安全で、ICI 治療を受けている患者にとって効果的だといえます。
同様に、造血幹細胞移植(HSCT) レシピエントにおけるさまざまなワクチンによる予防接種後の移植片対宿主病 (GVHD) の悪化に関する報告にはばらつきがみられます。したがって、免疫チェックポイント阻害剤ICI を受けている人、GVHD を患っている人、または GVHD を発症するリスクがある人は、推奨されているワクチンを避けるべきではありません。(その情報や研究結果には一貫性がなく、矛盾しているとされています。この状況では、ワクチンがGVHDを悪化させるかどうかは明確ではないため、その効果について一般的な結論を出すことが難しい、となります。)
異なる推奨されている非生ワクチン (表)を同じ来院時、または短い間隔で同時投与することは安全であり、ワクチン摂取量を増やすために強く推奨される戦略です。これは安全なアプローチであり、ワクチン間の免疫干渉はまずおこらないため安心して接種してください。
副作用を最小限に抑えるために、おのおののワクチン接種サイトを参照してください。(これは日本にもあります。)
患者さんと濃厚接触する可能性のある方、ご家族や介護者は、自分自身と周囲の人を守るために、年齢に応じたすべてのワクチンを受ける必要があります。
主治医、治療を担当するチームは、家族全員が季節性ワクチンを受け取ることをきちんとお話ししておく必要があります。
家族内での生ワクチンの使用の安全性はよくある質問です(生ワクチンは基本的に感染力を残した、弱めたものだからです)。
これらのワクチンには、水痘、おたふく風邪、麻疹、風疹(MMR)、弱毒化インフルエンザ生ワクチン(LAIV) などが含まれます。
がんの治療を受けている家族に感染する可能性があるため、濃厚接触者での使用について懸念が生じています。理論的にはもっともらしいですが、免疫不全の家庭内接触者への感染は稀であり、重大な結果を引き起こすことはありません。家庭内でこれらの伝染性の高い病気に対する免疫を維持するための適時のワクチン接種は、むしろ大きな利益をもたらします。したがって、がん患者の家族は、定期的に推奨されているすべての生ワクチンを受ける必要があります。唯一の例外は、造血幹細胞移植(HSCT) レシピエントの濃厚接触者には LAIV よりも不活化インフルエンザ ワクチンを優先的に使用することです。
他のリスクベースの生ワクチンの使用に関する注意事項は、ガイドラインで説明されています。(それぞれのワクチンごとに主治医に相談しましょう)
がん患者さんのワクチン接種のガイドラインが、米国で更新されていたので参考までに提示させていただきました。ただこれは米国のものであり、我が国とワクチンの内容やスケジュールなど、微妙に異なる点もあります。
主治医と相談して決めてください。
ただいくつか参考になる点がありました。
できれば生ワクチンの接種は避ける、不活化ワクチンがあるのならそちらを選択する、もそのひとつでしょう。またがんの治療に合わせて、スケジュールを調整できることもその一つです。皆さんのがん治療の参考になれば幸いです。
ホルモン受容体陽性 (HR陽性)、ヒト上皮成長因子受容体 2 陰性(HER2陰性)、リンパ節転移陽性の乳がん患者さんでは、再発リスクが高く (様々なデータがありますが5 年で最大 30%が見込まれます)、治療の強化、対策が必要とされてきました。
ホルモン剤による内分泌療法と併用して、2年間 術後に補助として アベマシクリブ(ベージニオ🄬)を飲用することは、現在では HR陽性HER2陰性、そして再発リスクが高いリンパ節転移陽性の患者に対する国際的に承認された標準治療になっています。
アベマシクリブは追跡期間中央値42カ月(4年弱)で、全患者が治療を終了した時点の2年間の治療を超えて、無浸潤病生存期間(IDFS)*および無遠隔再発生存期間(DRFS)の持続的な改善を示しました。
*無浸潤疾患生存期間とは、手術日から浸潤性病変の再発と判断された時点、またはあらゆる原 因による死亡日までの期間です。浸潤性病変とは、病理学的に、他臓器に転移を起こす能力があると判断される病変の総称です。つまりその病変の切除を行っても完治しない可能性が示唆される病変です。
全生存期間(OS)は未だ結論が出ていませんでしたが、今まで通りのホルモン剤による内分泌療法単独群と比較して、アベマシクリブを併用した群での死亡数が少なかったことから、おそらくアベマシクリブ併用群では最終的に生存率でも有利な結果が出ることが予想されていました。
ここでは最新のOSの評価結果を示します。
Rastogi P, O'Shaughnessy J, Martin M, Boyle F, Cortes J, Rugo HS, et al. Adjuvant Abemaciclib Plus Endocrine Therapy for Hormone Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative, High-Risk Early Breast Cancer: Results From a Preplanned monarchE Overall Survival Interim Analysis, Including 5-Year Efficacy Ou. Journal of Clinical Oncology. 2024.

ベージニオ🄬は比較的新しい薬剤でジェネリックも存在しないため、大変高価です。会計の時にびっくりされる方も多いと思います。
加えて代表的な副作用は下痢です。下痢とまでいかなくてもたいていは軟便で苦労されておられる方も多いと思います。脱毛や嘔吐が多くみられる抗がん剤とまではいかないまでも副作用のないものではありません。白血球もよく下がってしまいます。
できたら治療が完了した後まで飲みたくない、そう思われている方も多いのではないでしょうか。さらにそれが2年継続しますから大変です。
メリットがわかれば、デメリットの我慢もできる、そう思って紹介しています。
この臨床試験を、monarchE 第 III 相グローバル試験と呼びます。
合計 5,637 人の患者が 2 つの群に割り当てられました。
コホート 1 ( 5,120名)は、少なくとも 4 つの腋窩リンパ節 転移あり、または組織学的に異型度3以上、 あるいは 腫瘍のサイズ が5cm 以上、のいずれかの特徴を伴う再発の高危険群です。
コホート 2 ( 517名)は、1 ~ 3 個のリンパ節転移陽性、あるいは細胞分裂指数 Ki-67 ≧ 20% である患者が含まれていました。
これらのコホート 1 とコホート 2 の集団を
ホルモン剤単独で治療する群と、アベマシクリブを2年間併用してホルモン治療を行う群のふたつにランダムに(1:1)割り当てました。
結果
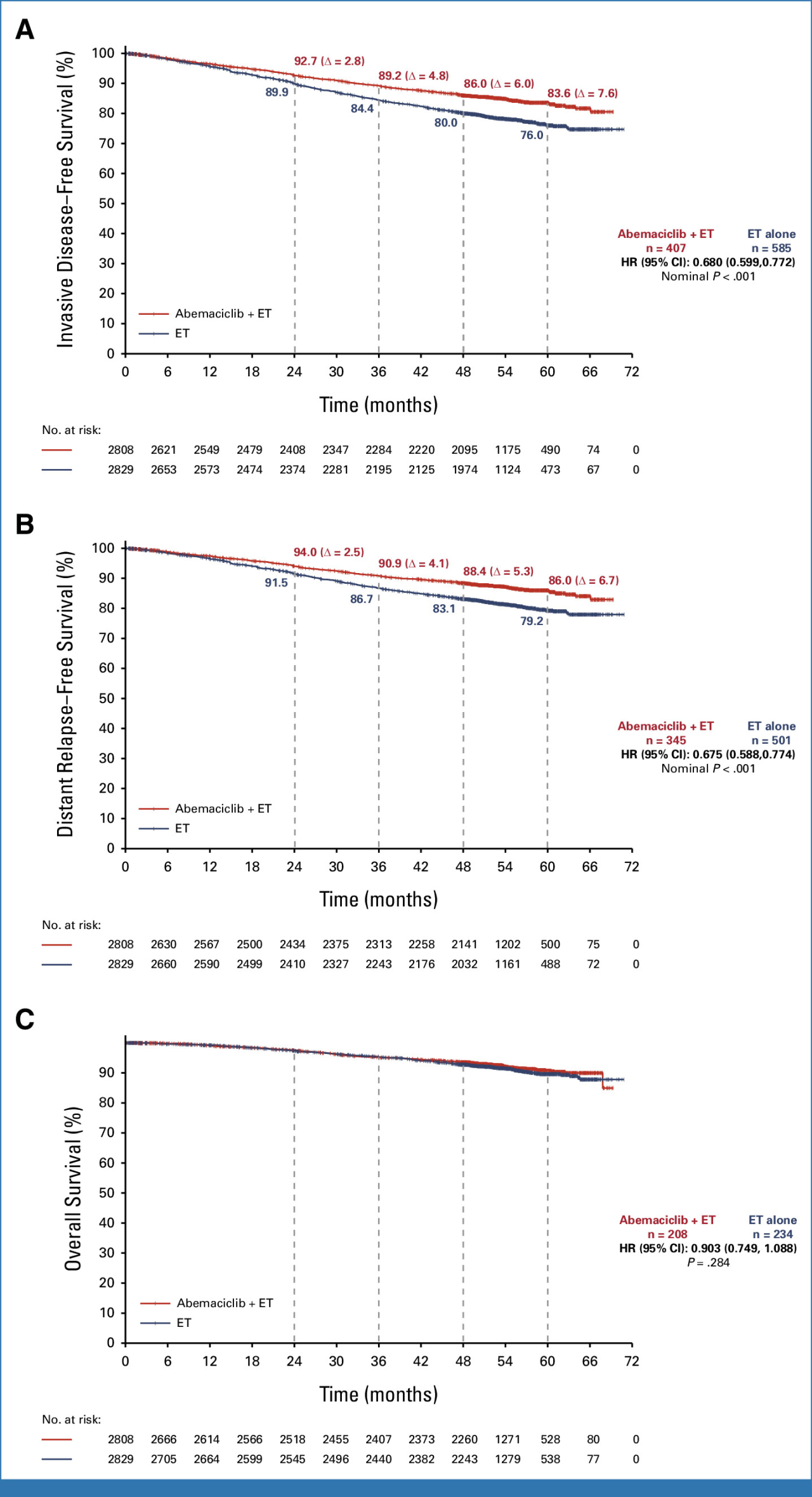
患者の約80%は少なくとも4年間(治療期間終了後2年)追跡されています。
術後に浸潤性病変の発生のリスクを軽減するというアベマシクリブの継続的な利点が統計学的に証明されました。実際には発生リスクを3割以上減少させました(HR、0.680, 95%CI; 0.599 ~ 0.772, p < .001)。上の図のAです。
術後に遠隔転移の発生のリスクを軽減するというアベマシクリブの継続的な利点もまた統計学的に証明されました。実際には発生リスクを3割以上減少させました(HR、0.675, 95%CI; 0.588 ~ 0.774, p < .001)。上の図のBです。
最終的な生存率では差が出ることがまだ証明されていませんが、時間の経過とともにそれも明らかになるでしょう。上の図のCです。
まとめ
アベマシクリブ(ベージニオ🄬)は、確かに高価で、2年間と長く、副作用も様々あるけれども、遠隔再発率を3割以上下げるなど、それに見合った効果があり、再発が予想される高リスクホルモンレセプター陽性HER2陰性乳がん患者さんには投与が強く勧められる、と言えるでしょう。
2023.08.15
今年7月27日 京都大学が乳がんの遺伝子変異に関して画期的な研究結果を発表しました。見れなくなる前にぜひ見ておいてほしい内容です。まだここから見れます。
とはいえ、この内容はかなり衝撃的なもので、ここで触れるかどうか、今の今まで悩んでいました。
乳がんの一部は、診断される数十年前、患者が10代前後の時点で、がんのもとになる最初の遺伝子変異が起きていたとみられることが遺伝子解析でわかったと、京都大学などの研究グループが発表しました。乳がんの早期発見や治療につながる可能性があると注目されています。
京都大学大学院医学研究科の小川誠司教授などの研究グループは、特定の遺伝子変異が原因とされる乳がんの患者9人からがんの組織などを採取して遺伝子解析しました。
変異の数から変異が起きた時期を推定したところ、いずれも、がんと診断される数十年前、患者が10代前後の時点で、がんのもとになる最初の遺伝子変異が起きていたとみられることがわかったということです。

今回の発表で、私が最も恐ろしいと感じたのは下の一文です。
一方、こうした遺伝子の変異は出産を1回経験するたびに55個減る計算になったということで、研究グループでは、妊娠や出産によって乳腺の細胞が置き換わることが影響している可能性があるとしています。

女性は、生理が始まる10歳台から時限爆弾のように乳がんの遺伝子変異の蓄積が始まる。それが出産、授乳を行えば巻き戻しが起こり、回復する。
どうも授乳が終わると、それまで使っていた乳腺の細胞が新しく次に備えて入れ替わるようです。しっかり授乳して、しっかり乳腺の細胞を使って、ボロボロになるまでミルクを与える。そして次に備えて作り直させる。そうすると変異した遺伝子をもつ乳腺細胞が減って巻き戻される。
巻き戻せるのなら、授乳しなくても生理のタイミングで巻き戻してくれればいいのに、なぜかそうはしないようです。授乳しない個体を”早死に”させたいかのように遺伝子の変異はただただ蓄積していく。これは不思議です。
第二次性徴を境に生殖に関する臓器にエストロゲン(女性ホルモン)の働きで遺伝子変異が蓄積し始める、同じことは生理が始まった子宮内膜にも言えるはずです。
でもそうはならない。なぜでしょうか。
子宮は、妊娠しないと生理になって内膜が剥がれ落ちて、排出されます。そしてまた新しく次の内膜が用意されます。ですので子宮内膜では先に述べた生理による遺伝子変異の巻き戻しが起こります。ですので原則として子宮内膜がん(子宮体がん)は閉経後に気を付ける必要がありますが、原則閉経前にはあまり警戒する必要がありません(稀ですがしかし”ありえます”ので注意してください)。
ただ乳腺は、実際に妊娠出産して授乳が行われないと破壊と再生が起こらない、と考えられます。確かに生理になったら張っていた乳腺が、乳頭から出血して出てきて、張りがなくなる、なんてことはないですから。
子宮は例えばサメなどの魚類にも同じ働きが認められる臓器があります。進化の過程では子宮は古くからある臓器です。でも乳腺は哺乳類から現れる臓器です。進化の過程では比較的新しい臓器なのです。ですのでそういう遺伝子変異から守る働きが進化していないのかもしれません。まして元気で、栄養状態もよく、異性も豊富に存在している、それでいて、出産しない、授乳しない、そんな哺乳類は人類しかいませんから。今後もなかなか進化しないでしょう。

”なぜ乳がんはこんなに増えているのでしょう?”
これはよく言われる質問です。しかし今回の京都大学の発表はこれにゆるぎない回答を与えたことになります。そう”少子化”が原因なのです。授乳する機会が減っていること、そして減り続けていること、それが原因なのです。食べ物、食事内容、たんぱく質を多くとる、それらは直接的には関係ないのです。
少子化が原因である、それを裏付ける根拠はいくらでもあります。
一つ例を出しましょう。乳がんは40から50歳代の若い女性がなる、そう考えておられる方が多いのではないでしょうか?
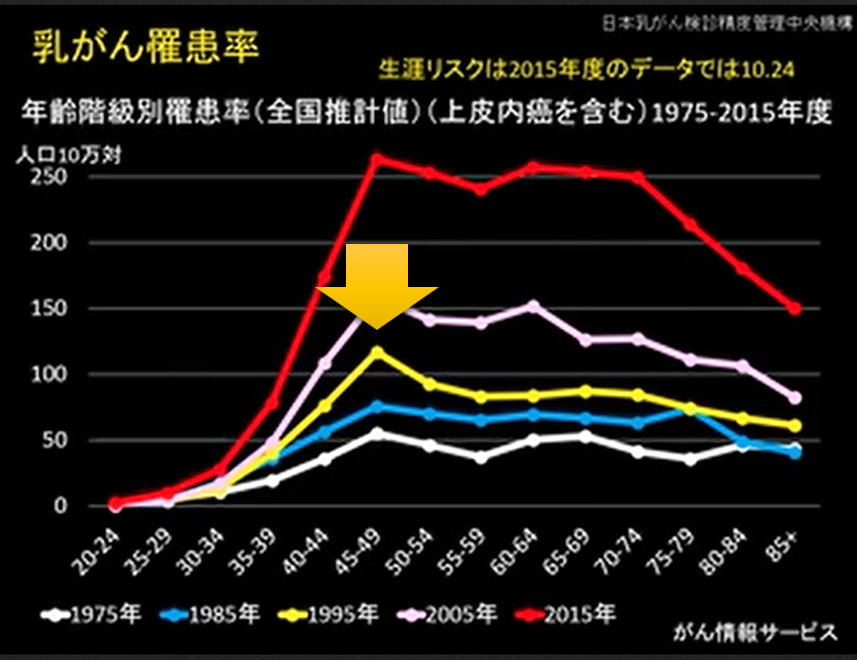
このグラフは 年齢別に 乳がんに罹患する確率を10年ごとに示したものです。
1995年(黄色の線) 乳がんが40-50歳で爆発的に増加しています。いまから30年前のことです。”乳がんは40歳から50歳くらいの若い人がなる” この考え方はこのころ形成されました。
でもそれは”若い人に多い”のではなく”高齢者で乳がんが少ない”だけなのです。
実は1995年に50歳前後の方は、団塊の世代に相当します。団塊の世代(だんかいのせだい)とは、日本において第一次ベビーブームが起きた時期に生まれた世代を指します。第二次世界大戦直後の1947年(昭和22年)4月2日〜1950年(昭和25年)4月1日に生まれています。1995-1950=45なのでわかりますね。
つまり団塊の世代から若年者の乳がんが急増し始めました。それは団塊の世代こそ、少子化が始まった最初の世代だからです。団塊の世代を生み出した、その親、祖母の時代は子供をたくさん産んでおられた、だから乳がんが少なかったのです。団塊の世代は自分たちの人数が多いので、子供をあまり作らなくなったのです。ですので急に乳がんの罹患率が増えた。そのとき”乳がんは若い人のがん”という認識が作られたのです。
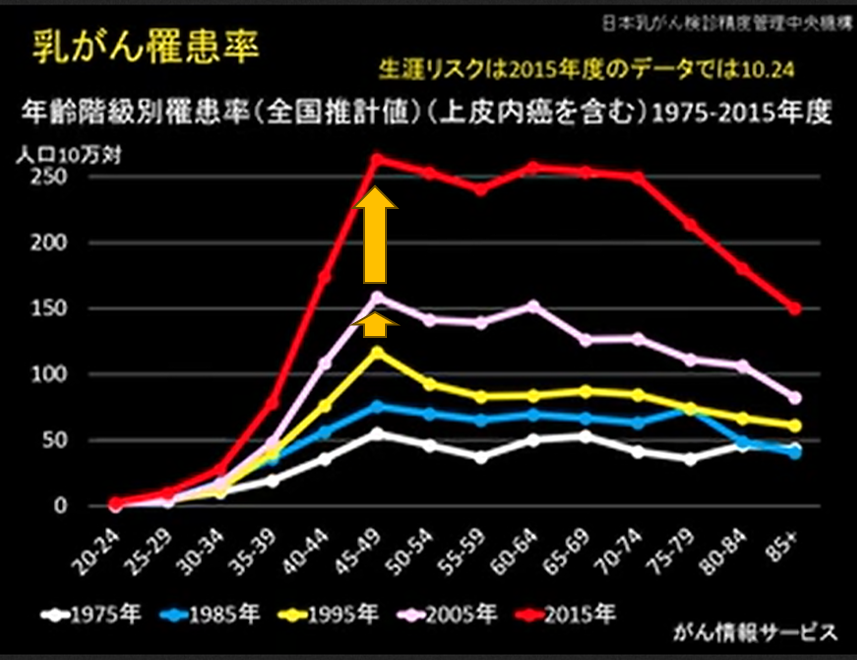
少子化はしかしそこで止まっていません。一人の女性が生む数は減り続けました。現在では特殊出生率(女性一人が一生で産む数)は1.3まで減少しています。もちろんその40歳から50歳の乳がんの罹患率は 黄色からピンク、赤と時間経過とともに増加の一途です。
ただ団塊の世代もまた、10年おきに60歳、70歳と高齢になっていきます。そして高齢者の乳がん罹患率の伸びもまた明らかに認められるようになりました。つまりじわじわと乳がんは若い女性のがんではなくなってきたのです。
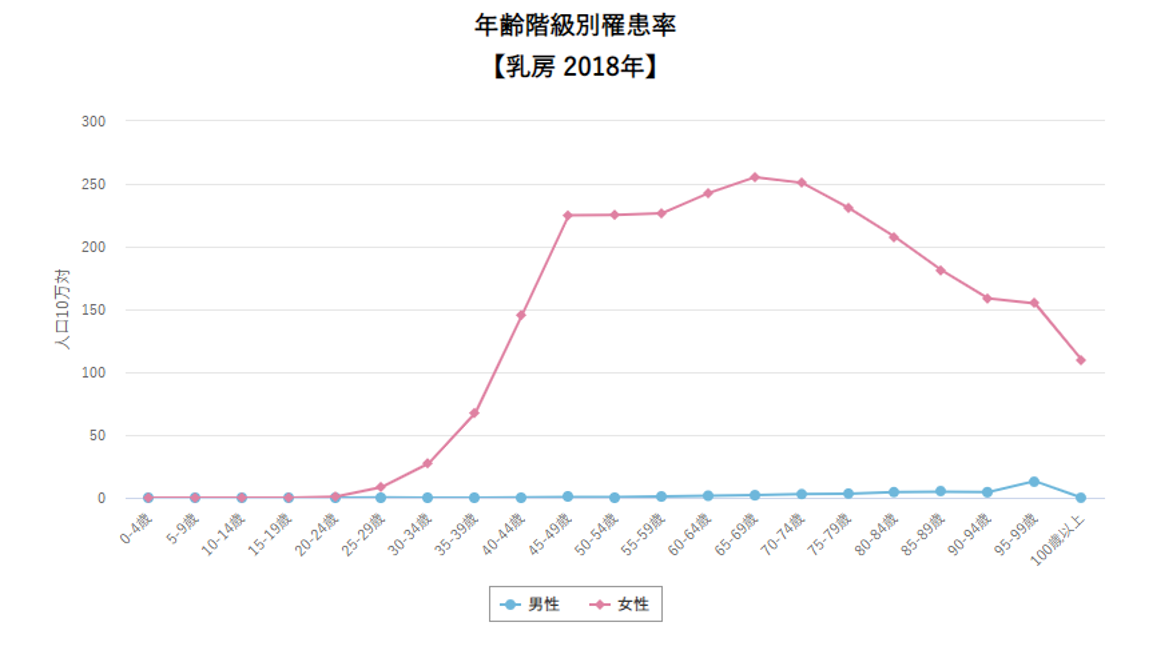
上記はがんセンター発表の最新データです。
乳がん罹患率の年齢階級別分布ですが、もう40歳から50歳がピークではありません。
現在の乳がん罹患率のピークは65歳から75歳なのです。中止してほしいのは、この数値は数ではありません、率です。乳がんに罹患する確率が高いのは今は”高齢者”なのです。
ただこのグラフ、まだ不自然ですよね、何か山の頂上がかけたような形になっている。
乳がんを引き起こす遺伝子異常が年齢依存性に蓄積するなら、このグラフの形はなだらかに頂上をつくらなければおかしい。いくら閉経すると蓄積するスピードが落ちるとは言ってもです。閉経は50歳から60歳で起こりますしね。
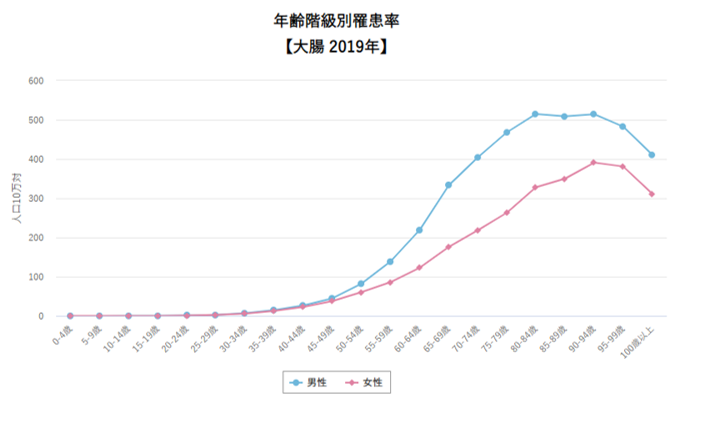
ちなみに他のがんだとどうなんでしょう。
上記のグラフは大腸がんの年齢別罹患率です。自然なカーブだと思いませんか?
年齢に伴って 遺伝子異常の蓄積が起こるなら、この形が自然なはずです。
年齢が上昇するほど、遺伝子異常が限界に達する確率が上がるからです。
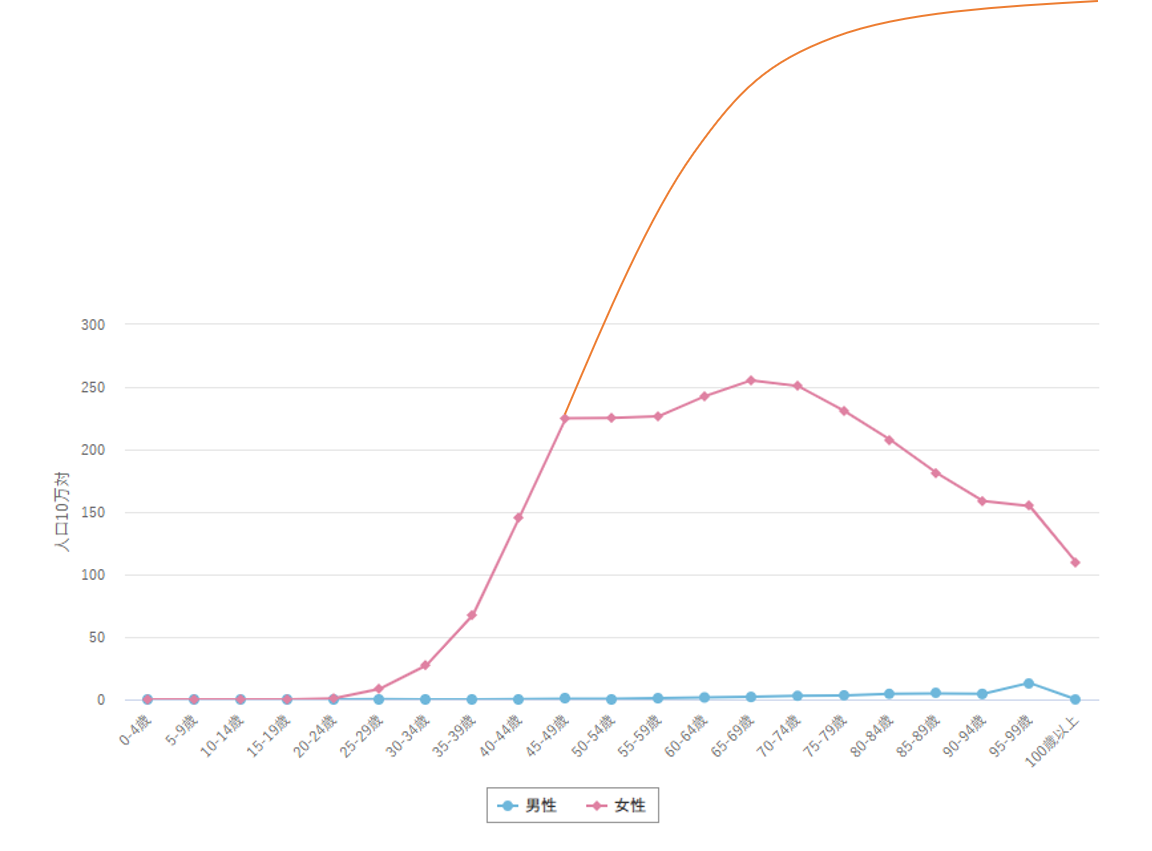
乳がんも本来上の図のようなグラフでなければ変ですよね。こんな形は不自然です。
つまり 現在もまだ、高齢の方の乳がんは抑制されていると考えた方が自然です。
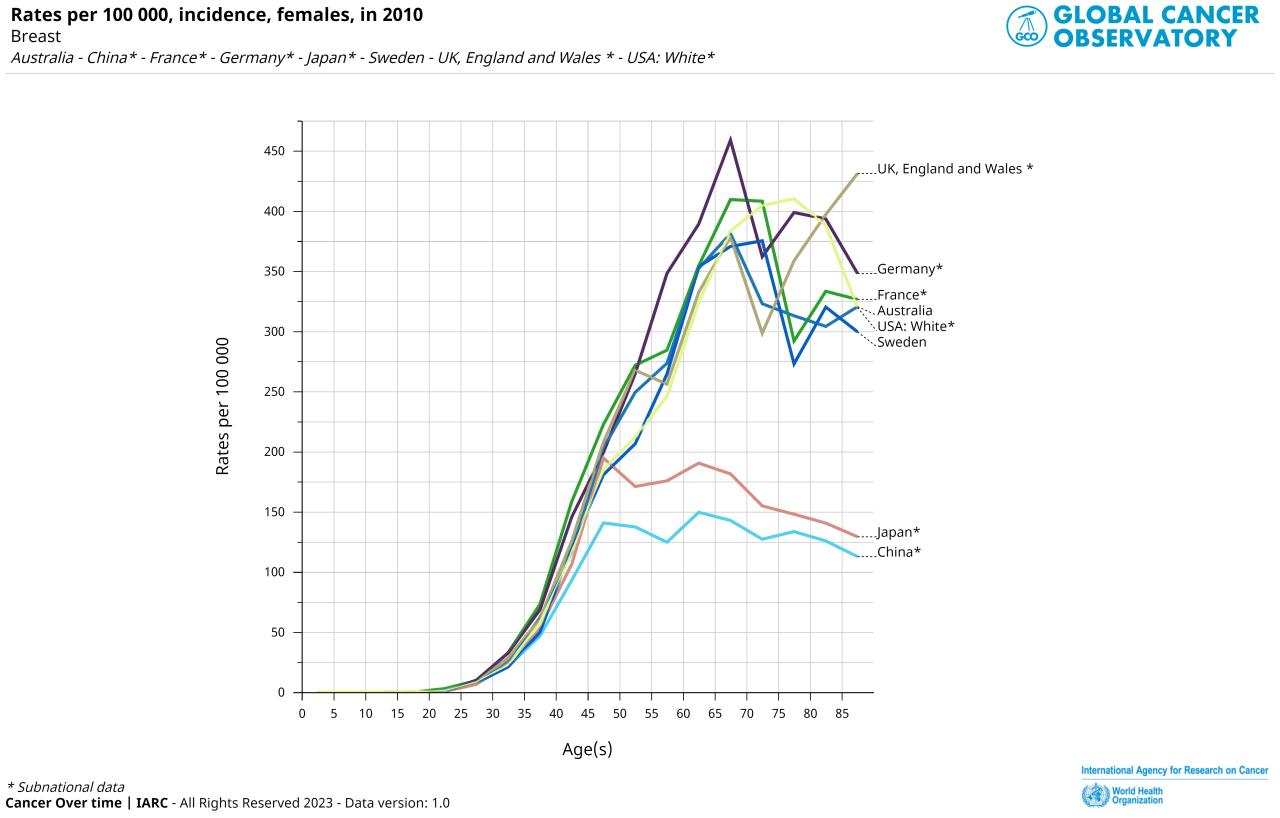
上のグラフは日本以外の先進国も含めた、乳がんの年齢別罹患率のグラフです。
そういう自然な形になっています。ヨーロッパや米国では日本よりも早くから平均出生率の低下が起こり落ち着いています。ですので歴史上その形に早く到達しているのです。
対して中国(China)で有名な一人っ子政策は1979年からです。日本のベビーブームは1975年です。不気味なくらいグラフの形が似ています。この頂上の欠けた形は、どこかの年齢をきっかけに急激に少子化が進んだ国の特徴的なグラフなのです。日本も中国も、また戦前のようにたくさん産むようにはならないでしょう。ですのでヨーロッパ先進諸国の形に重なるようになってくると予想されます。
ただ米国やヨーロッパの国々の出生率はそれでも1.7程度です。日本は1.3、中国は一人っ子なので1前後です。となればこのグラフの上に行く可能性もあり得ます。
結論から言えば、日本でも乳がんは高齢者のがんになる、そして現在の50歳以上の方と比較して、これからの50歳以上の方の乳がん罹患率は単純に見積もっても”倍以上になる”可能性が高いのです。
2023.07.11
ここからは残された疑問に関して、この論文のまとめを引用していきます。
私が多少の解説を加えて医師以外でも読みやすくしています。ただPFS OS IDFSなどの言葉がわからないと、まずちんぷんかんぷんになるでしょう。その1から3までを読んでから挑戦してください。IDFSは我々にも少しなじみがない指標ですが、乳房以外の二次悪性新生物、乳房内であっても乳管内がんでの局所再発が発生しても再発とせずに統計を行い、再発無しでの生存期間を調査したという値になります。
1 すべてのCDK4/6阻害剤は ホルモン感受性ありHER2陰性の閉経後転移性乳がんのPFSを延長する。しかし転移性乳がんのOSの延長効果と、術後補助療法での無再発生存期間における効果はイブランス🄬にだけ認められないのはなぜか。
筆者はこの問題に焦点を当てながら 2-5の疑問点への回答を探っていきます。
CDK4/6阻害剤は3剤ともほぼ1年PFSを延長しました。つまりいままでのホルモン剤単独であれば1年程度で効かなくなっていたものを2年程度まで効果を持続させることに成功したのです。であるならば、乳がんが再発してから亡くなるまでの最終な生存期間であるOSも1年延長していてもいいはずです。PALOMA-2の90か月(8年間)の経過観察で、結局イブランスはOSの延長を証明できませんでした。実際にはホルモン剤単独51.2か月のOSを、ホルモン剤にイブランス🄬の併用で53.9か月としたのみです。
たいしてキスカリ🄬は51.4か月を63.9か月まで延長しています。ベージニオ🄬の最終結果は2023年発表ですが、54.5か月を67.1か月に延長しそうです。残り2剤はPFSを延長した分、OSもきちんと延びていそうだ、と言えます。
しかしなぜイブランスだけOSを延ばせなかったのでしょうか?
現在はキスカリ🄬だけが、閉経後、そして閉経前ホルモン受容体陽性HER2陰性転移性乳がんにおいてもゾラデックス🄬などのLH-RH阻害剤併用を行うことによって、一次治療において、OSに有意差を証明しています。
二次治療ではどうでしょう。転移再発後、一次治療をおこない、それが効果がなくなった後であっても、キスカリとフェスロデックス🄬の併用療法は12.8か月を20.5か月までOSを延長しました。ベージニオとフェスロデックス🄬の併用は9.4か月延長しました。
要約すると、キスカリ🄬 とベージニオ🄬 はホルモン剤と併用することで、ホルモン感受性HER2陰性転移再発乳がんのPFSが延長した分の OS も改善しますが、イブランス🄬では PFSは延長しますが、OS での利点は実証されませんでした。
さらに加えて転移が想定される環境では一貫して PFS を改善する薬剤が、術後補助治療環境では OS も IDFS も改善しないのはなぜかという大きな疑問が残っています。CDK4/6阻害剤はホルモン剤に反応する転移再発乳がんの治療において、一律にPFS=無増悪期間を延長します。しかし高リスク乳がんと呼ばれるたとえ早期発見されていても、微小転移が存在していることが予想される乳がんに対して、予防的に術後に投与しても効果が一律には得られないのです。現在その目的で保険収載され、使用されているのはベージニオ🄬だけですが、キスカリ🄬もその効果が認められました。
IDFS には乳房以外の二次悪性新生物が含まれることが制限されていますが、パルボシクリブ🄬はIDFSを他薬剤ほど改善しませんでした。
これらのデータは、治療にあたる主治医が 数種類あるCDK4/6阻害剤を、同等のものとして互換的に処方すべきではないことを示唆しています。 患者には慎重にカウンセリングを受け、副作用プロファイルとOSに関して観察された一貫した差異に基づいて治療法を個別化して受ける必要があります。
残された疑問2から6に関与して、CDK4/6阻害剤を使用後 もしその効果が得られず、あるいは得られなくなり、再進行開始後にホルモン剤単剤治療は効果があるのでしょうか?
これに対する回答としてCDK4/6阻害剤併用のホルモン治療後に、転移性乳がんが再進行した後、標準的なアプローチは現在ありません。
オプションには alpelisib (日本未認可、ホルモン剤併用) 、アロマシン🄬とmTOR 阻害剤エベロリムス(アフィニトール🄬)などがあげられます。ただ複数の研究で、ホルモン受容体陽性HER2陰性の進行あるいは転移性乳がん患者のCDK4/6阻害剤(主にパルボシクリブ🄬)併用による内分泌療法治療後、再燃した場合のホルモン剤単独療法群におけるPFSが驚くほど短いことが確認されました。現在日本では保険未収載の強力な臨床抗腫瘍活性を示した経口選択的エストロゲン受容体分解剤の多くもまた、残念ながらCDK4/6阻害剤による治療後は限定的な臨床活性を示しました。
イブランス🄬使用後、再進行が始まった後の二次治療ホルモン剤単剤療法では急速な進行が起こることが知られています。この急速な進行の1つの説明は、CDK4/6阻害剤の中止後に、それまでせき止められていた細胞分裂回転(G1/S)の遮断が急激に解放された腫瘍細胞が放出されることだと考えられています。 注目すべきことに、この現象は、キスカリ🄬投与後の進行後治療の統合解析では観察されませんでした。
イブランス🄬投与によって達成された PFS の改善は、二次治療に入った段階では維持されず、むしろ増悪速度が上昇するため、これが OS の利点の欠如に寄与している可能性があることを示唆しています。
筆者注:ここまで書いていて怖くなりました。ちなみにこの論文の筆者のO'Sullivan先生の研究はLily社から資金提供を受けています。たくさんの製薬会社から受けておられますが、筆頭はLily社でした。日本ではイーライリリー社です。
ベージニオはイーライリリー社の薬剤です。
キスカリ🄬はノバルティス社です。
イブランス🄬はファイザー社です。
あとはお察しください。ただこの論文はいま医師たちによく読まれていることは事実です。
私はどの会社からも資金提供は受けていません。
2 CDK4/6阻害剤は基本的に高価である。そして副作用もある。ホルモン感受性ありHER2陰性の閉経後再発乳がん患者さんは、全員にCDK4/6阻害剤を併用したほうがいいのだろうか?としたらどのCDK4/6阻害剤を選べばいいのだろうか。ホルモン感受性が非常に高い再発の一次治療の際、いままでホルモン剤単独療法で対応して、必ずしも悪い結果ではなく、何年もそれだけで問題なかった症例は存在していた。そういう患者さん、つまりとりあえず一次治療は今まで通りホルモン剤単独でいい患者さんを見分けるマーカー、指標のようなものはないのだろうか?ホルモン剤による一次治療に反応しなくなった際に初めてCDK4/6阻害剤の使用を勧める、これを見分ける指標はあるのだろうか?
Lum AとLum Bタイプで比較した際、HER2の陽性細胞の比率が高いほど、ホルモン剤単剤での治療と比較してキスカリ🄬の併用が有意に優れたPFSを示しています。(この研究はHER2陰性を対象に行われましたが、HER2陽性細胞が0というわけではなく、少ない、あるいは発現が弱いものも陰性としています。一般にLumBタイプの方がLumAタイプの方と比較してHER2にわずかながらでも発現している乳がん細胞が多い傾向があります。)
→ HER2陰性であっても、わずかでも発現していればそれが強ければ強いほどCDK4/6阻害剤の併用を勧めた方がいい。
内臓転移、特に肝転移をともなう閉経後転移性乳がん症例では、ホルモン剤単剤よりも、ベージニオ🄬併用のほうが効果が期待できることが示されています。
De novo Stage IV乳がんではホルモン剤単独療法と比較して、最初からキスカリ🄬を併用することで予後が改善することがわかっています。
(「De novo Stage IV」という用語は、がんのステージング(進行度分類)に関連しています。ステージIVは、がんが最も進行したステージであり、他の臓器や組織に広がっていることを示します。「De novo」は、ラテン語で「新たに」という意味です。したがって、「De novo Stage IV」は、「最初からステージIV」という意味で、がんが最初の診断時点で既に他の臓器に広がっていることを指します。これは、初めてがんが見つかった段階でがんが進行転移していることを示す用語です。通常、がんは初期ステージで発見され、進行するにつれてステージが上昇していきます。しかし、De novo Stage IVの場合、がんが最初の診断時点ですでに進行しており、他の臓器に転移していることが明らかになっています。)

副作用について
ホルモン剤単独療法と比較して、CDK4/6阻害剤を併用すると、副作用が増加する可能性がありますが、全体的な生活の質の低下は観察されていません。
イブランス🄬とキスカリ🄬の場合は、最もみられる比較的重篤な副作用は好中球減少症です。キスカリ🄬は、QTcF 間隔の延長(キスカリ🄬とタモキシフェンの投与を受けた患者では約 16%、キスカリ🄬とアリミデックス🄬あるいはフェマーラ🄬 の投与を受けた患者では 7%)と、血清トランスアミナーゼの上昇(肝機能異常)を引き起こす可能性があり、これが治療中止に至る最も頻度の高い理由です。
(筆者注:QTcFは、心電図(ECG)の解析において使用される指標であり、心臓の電気活動の正常性を評価するために使用されます。QTcFの延長は、心臓の電気活動に異常があることを示す可能性があります。正常な心電図は、一定の間隔で心室の収縮と再分極が行われます。しかし、心臓の特定の状態や薬物の副作用などによって、QTインターバルが長くなることがあります。QTcFの延長は、心室頻拍(ventricular tachycardia)や心室細動(ventricular fibrillation)などの異常な心拍を引き起こす可能性があります。特定の薬物は、QTcFを延長させることが知られており、これは重篤な副作用を引き起こす可能性があるため、医師は薬物の使用に際してQTcFのモニタリングに注意を払うことがあります。)
ベージニオ🄬は、イブランス🄬やキスカリ🄬とは異なる薬理学的および毒性プロファイルを持っています。ベージニオでは好中球減少症は少ないですが、下痢、吐き気が多く、頻度は低いですが静脈血栓塞栓性イベント(5%)が発生します。下痢は 一般に悪性度は低く、減薬や入院につながることはほとんどありません(筆者注 でも下痢止めの薬を併用しておくことがほぼ必須です)。臨床試験において患者の約 81% が下痢を報告しました(筆者注:これは多いでしょう。それに生活の質は落ちないと書かれていますがやはり落ちるでしょう。)。
CDK4/6阻害剤による好中球減少症の発生率は高いですが、発熱性好中球減少症はまれです。またこれが起こった際には用量をそれに応じて次第に減量していくことが多いのですが、それを減量してもPFS に悪影響を及ぼしません。その他のまれなことですが、 重篤な副作用には、間質性肺疾患/肺炎および静脈血栓塞栓症イベントが含まれます。
まとめ(これは私が書いています)
ホルモン感受性あり、HER2陰性乳がんがたとえばリンパ節転移が激しい、皮膚に著明に浸潤しているなど、進行して見つかった場合、また残念ながら再発してしまった場合は、やはり現状ではホルモン剤とCDK4/6阻害剤の併用が最初から勧められると思われる。
長期間(5年以上)ホルモン剤を飲用しながら経過していて、骨転移で再発が見つかった(つまり肺や肝臓など内臓に転移がなければ)場合などで併用しないことも検討される。
早期乳がんであっても、LumBタイプでHER2がわずかでも陽性である、Ki67の値が20%を超えるなど、悪性度の高い乳がんであった場合は、再発予防の観点からCDK4/6阻害剤の数年間の併用を行っておくことが勧められる。
この論文からはイブランス🄬に有利な点は読み取れない。しかし実際の使用感からはイブランス🄬は比較的副作用がコントロールしやすく、軽いという特徴がある。CDKをすべてブロックすると副作用が強すぎて薬としか使えないことから、CDKをどこまでブロックするか、効果と副作用の兼ね合いで検討する必要があるのだろう。CDK4/6阻害剤の併用の有無、薬の選択については、費用、副作用、そしてその方のがんの状況によって複雑に影響されるため、主治医としっかり話し合って決めていく必要があるだろう。
2023.07.07


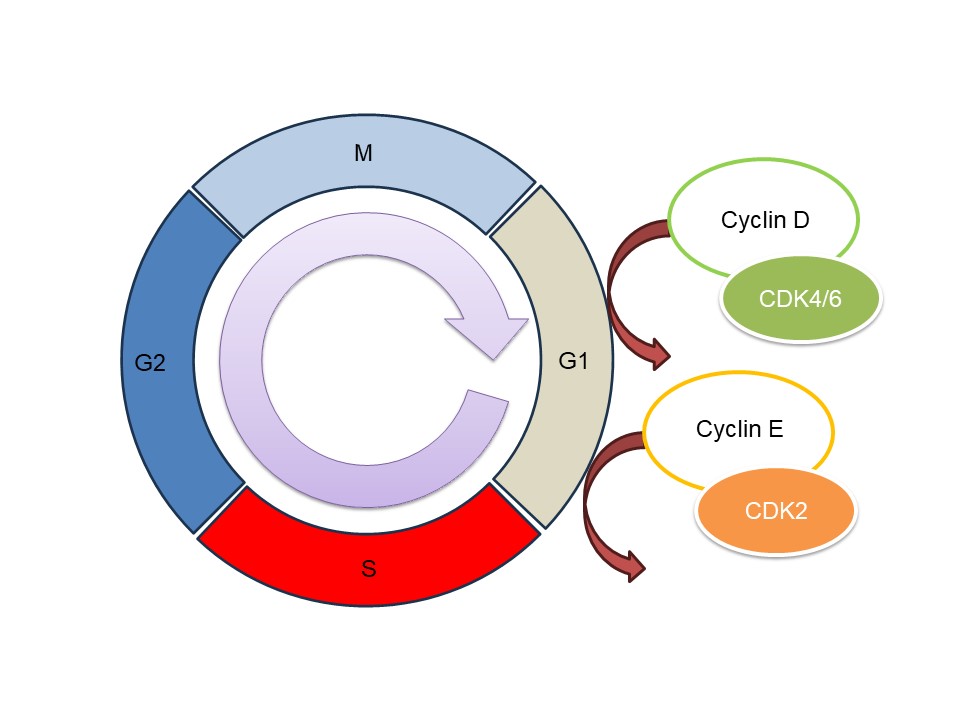
細胞は分裂することで増殖します。細胞分裂は周期があり、これが回転して1個が2個、2個が4個と増えていきます。これを自転車が走って進んでいくことにたとえます。後輪が回転して自転車が進むことで、がんが増殖するとします。
がん細胞に限らず、細胞はCyclin Dと呼ばれるタンパクの存在によって、細胞はG1期からS期へと進行し、DNAの複製を行うことが可能になります。つまり細胞分裂が進んでいきますが、このCyclin Dは自転車のペダルのようなもの、と思ってください。
Cyclin DはCDK(サイクリン依存性キナーゼ)と結合します。CDKは細胞内に存在しているタンパク質キナーゼです。これはペダルをこいでいる足と思ってください。誰かが漕がないとペダルは回りません。
Cyclin DにCDKが結合するとペダルが回り始め、それは特定のタンパクにリン酸基を付加することで細胞内のシグナル伝達を制御します。このリン酸基はチェーンのようなものです。チェーンは後輪に力を伝えます。
こうして自転車の進行(細胞の増殖)は、細胞周期の進行(後輪の回転)で起こり、それはCyclin D-CDK複合体の形成と活性化(漕ぎ手がペダルをこいで、リン酸基をチェーンとして伝える)によって厳密に制御されています。
このCDK4/6を阻害することに成功すれば(漕ぎ手を奪ってしまえば)少なくとも無制限な細胞分裂は止まります。CDK4/6阻害剤 (パルボシクリブ(イブランス🄬)、リボシクリブ(キスカリ🄬)、アベマシクリブ(ベージニオ🄬)) と内分泌療法 (ホルモン剤) の併用療法は、ホルモン受容体陽性HER2陰性の進行あるいは転移性乳がんの治療に大きな進歩をもたらしました。標準治療がついに書き換わろうとしています。
さあお待たせしました。ここから論文の内容に入ります。
ホルモン受容体陽性、ERBB2陰性乳癌に対するサイクリン依存性キナーゼ4/6阻害剤:総説
O'Sullivan CC, et al: JAMA Oncol 2023
ランダム化第三相試験の結果から、ホルモン感受性HER2陰性の閉経後転移性乳がんの一次治療、二次治療におけるホルモン単独療法 (アロマターゼ阻害剤、タモキシフェン、またはフルベストラント) と比較して、CDK4/6阻害剤を追加することで疾患進行のリスクが約半分に減少することが実証されました。
これにより米国食品医薬品局と欧州医薬品庁は、一次治療、二次治療の両方で 3 つの CDK4/6阻害剤 の使用を承認しました。ただし、作用機序、副作用の内容、全生存期間 (OS) に関しては、3つのCDK4/6阻害剤の間で違いが明らかになりつつあります。
たとえばベージニオ🄬とキスカリ🄬はどちらも、進行再発乳がんだけではなく、高リスクホルモン受容体陽性早期乳がんに対する有効性を実証しています。イブランス🄬では証明されていません。
標準治療が3つもあっては困ります。ジェネリックのように基本同じ効果、同じ副作用であるならばまだしも、効果も副作用も異なるのでは混乱してしまいます。どこが違うのでしょうか。そしてどう使い分ければいいのでしょうか。

まずこれら3剤が乳がん治療に与える効果を証明した研究を復習してみましょう。
PFS、OSについてはもういいですか?理解していますか?もしまだでしたらその2を読んでおいてください。
一次治療、これは再発や進行(手術にならない)がんが見つかって最初の治療ということです。二次治療、これは一次治療で反応しなかった、あるいは反応していても再び進行が始まった際の二番目の治療を意味します。
PALOMA-1 : ホルモン感受性ありHER2陰性の閉経後転移性乳がん治療が対象
フェマーラ🄬単独とフェマーラ🄬+イブランス🄬の比較です。
一次治療においてPFSを10.2 か月から20.2か月に延長した(Phase 1/2)
ただしそれによるOSへの影響は証明できていない。
PALOMA-2:ホルモン感受性ありHER2陰性の閉経後転移性乳がん治療が対象
フェマーラ🄬単独とフェマーラ🄬+イブランス🄬の比較です。
一次(二次)治療においてPFSを14.5 か月から24.8か月に延長した(Phase 3)
ただしそれによるOSへの影響は証明できていない。
MONARCH-3:ホルモン感受性ありHER2陰性の閉経後転移性乳がん治療が対象
ホルモン剤単独とホルモン剤+ベージニオ🄬の比較です。
一次(二次)治療においてPFSを14.7 か月から28.2か月に延長した(Phase 3)
OSへの影響は、証明はされていないが、二次治療で改善が認められた。
MONALEESA-2:ホルモン感受性ありHER2陰性の閉経後転移性乳がん治療が対象
フェマーラ🄬単独とフェマーラ🄬+キスカリ🄬の比較です。
一次(二次)治療でにおいてPFSを16.0か月から25.3か月に延長した(Phase 3)
OSへの影響は、証明はされていないが、一次・二次治療で改善が認められた。
MONALEESA-7:ホルモン感受性ありHER2陰性の閉経前転移性乳がん治療が対象
タモキシフェンあるいは AI + LH-RH (ゾラデックスあるいはリュープリン)単独と
このホルモン治療+キスカリ🄬の比較です。
一次(二次)治療でにおいてPFSを13.0か月から23.8か月に延長した(Phase 3)
ただしOSへの影響は証明できていない。
それぞれ素晴らしい成績です。基本 ホルモン剤単独であれば1年程度であった効果が、CDK4/6阻害剤を追加すれば2年に延長する、ことが分かったのです。これは大変すばらしい成績です。PALOMA2の成績が発表された時、私も米国臨床腫瘍学会(ASCO)の現場でこれを聞いていましたが、会場の乳がん関連の発表がこればかり注目されて他がかすんでしまっていたことを覚えています。
標準治療が書き換わる、これは大変なことです。
これ以降、ホルモン感受性ありHER2陰性の閉経後転移性乳がん治療の、一次治療は、二次治療は、ホルモン剤単独ではなく、ホルモン剤にCDK4/6阻害剤を併用すること、が標準治療となりました。
日本乳がん学会の治療ガイドラインにも「非ステロイド性アロマターゼ阻害薬とCDK4/6阻害薬の併用が第一に検討される」の一文が添付されました。
しかし気付かれた方もおられるでしょう。そう3剤でイブランス🄬だけはOSでの延長効果が認められませんでした。

CDK4/6阻害剤のこうした成功を受けて、手術もできないような局所進行がん、再発乳がんだけではなく、手術可能な比較的早期乳がんであっても再発リスクの高い、悪性度の高い乳がん患者さんに、術後にCDK4/6阻害剤を予防的に投与すれば再発は減るのではないか、この研究が行われました。
術後補助療法において、ホルモン剤単独 VS ホルモン剤+CDK4/6阻害剤という臨床試験です。
しかし 実はこの研究がいま起こっているCDK4/6阻害剤における混乱のもととなりました。
ホルモン感受性乳がんにおける術後補助療法における CDK4/6阻害剤の使用を評価する前向き試験では、矛盾する結果が示されています。
PALLAS 試験 (n = 4600): ホルモン感受性HER2陰性 ステージ2、3の乳がんにおける術後補助療法
ホルモン剤単独 vs ホルモン剤+2年間のイブランス🄬
2回目の中間解析では、研究は無駄であるとして中止されました。
3年間での浸潤癌の再発無しで生存される確率は 単独で88.5%、併用で88.2%と差がありませんでした。
Monarch-E (n = 5637) :ホルモン感受性HER2陰性 高リスク乳がんにおける術後補助療法
ホルモン剤単独 vs ホルモン剤+2年間のベージニオ🄬
2年間での浸潤癌の再発無しで生存される確率は 単独で89.3%、併用で92.3%
4年間での浸潤癌の再発無しで生存される確率は 単独で79.4%、併用で85.8%
改善効果が証明されました。
これをうけて米国、そして日本でもKi-67 が 20% 以上のリンパ節転移陽性ホルモン受容体陽性HER2陰性乳がん患者に対して術後補助療法としてベージニオ🄬とホルモン剤の併用を承認しました。
NATALEE 試験:ホルモン感受性HER2陰性 高リスク乳がんにおける術後補助療法
ホルモン剤単独 vs ホルモン剤+3年間のキスカリ🄬
これはこの論文の時点では結果が発表されていませんでしたが現在は出ています。
3年間での浸潤癌の再発無しで生存される確率は 単独で87.1%、併用で90.4%
改善効果が証明されました。
気付かれた方もおられるでしょう。そう3剤でイブランス🄬だけは補助療法として効果を証明できませんでした。

ただ同じような薬剤が3剤もあればそれだけでも混乱します。
同じ効果、同じ副作用なら、一番安い薬がベストでしょう。ただ先に述べたように効果も、そして副作用も異なるのです。標準治療とまで言うのなら、そこをはっきりさせる必要があります。
残された疑問
1 すべてのCDK4/6阻害剤は ホルモン感受性ありHER2陰性の閉経後転移性乳がんのPFSを延長する。しかし転移性乳がんのOSの延長効果と、術後補助療法での無再発生存期間における効果はイブランス🄬にだけ認められないのはなぜか。
2 CDK4/6阻害剤は基本的に高価である。そして副作用もある。ホルモン感受性ありHER2陰性の閉経後再発乳がん患者さんは、全員にCDK4/6阻害剤を併用したほうがいいのだろうか?としたらどのCDK4/6阻害剤を選べばいいのだろうか。ホルモン感受性が非常に高い再発の一次治療の際、いままでホルモン剤単独療法で対応して、必ずしも悪い結果ではなく、何年もそれだけで問題なかった症例は存在していた。そういう患者さん、つまりとりあえず一次治療は今まで通りホルモン剤単独でいい患者さんを見分けるマーカー、指標のようなものはないのだろうか?ホルモン剤による一次治療に反応しなくなった際に初めてCDK4/6阻害剤の使用を勧める、これを見分ける指標はあるのだろうか?
3 CDK4/6阻害剤を使用しながら腫瘍が再び増悪を始めた、その際に、ホルモン感受性は失われていることが報告されている。それはCDK4/6阻害剤の種類によって差があるだろうか?
4 CDK4/6阻害剤が利かなくなるのはなぜだろうか?その耐性獲得の機序はどうなっているのだろうか?それはCDK4/6阻害剤の種類によって差があるだろうか?
5 腫瘍の微小環境はどのようにCDK4/6阻害剤への反応性に影響するのだろうか?それはCDK4/6阻害剤の種類によって差があるだろうか?
6 失われてしまったホルモン感受性は戻ってくるのだろうか?もし可能ならどうやって?
2023.07.07
がんはこの現在においても完治は難しい疾患です。
手術や放射線治療といった局所治療がいまでもなくならないことがその証拠です。
手術は切除したところしか治せない、放射線も当てたところしか治せません。もちろん全身を切除することも、全身に放射線を浴びせることもできません。なので局所治療と言います。
たいして抗がん剤やホルモン剤は全身治療と言います。薬を飲めばその薬は全身に余すところなくいきわたります。もちろんがんではない部位に行く必要はありません。しかし現在の医療では、がんがある部位、たとえば転移が隠れている場所、小さな早期がんが発生した部位を見つけることができない、なのでがんが全くない部位を完全には区別できません。もしできたとしてもいつ発生するかわからない。ですから全身にくまなく効く薬の方が都合がいいのです。そしてその薬がたとえがんのない部位に効いても副作用がなく、がんがある部位に効いてがんが完全に消えるような薬ができればがん治療は完成します。
ですので固形癌とよばれる胃がんや乳がん、大腸がんを手術しているうちはまだそういった薬、治療法は完成していない、と言えます。
今でも毎週のように新しい薬が開発、発表され、臨床試験が行われています。新薬の99%は日の目を見ずに終わるとされます。効果がなかった、は論外として、副作用が強すぎて使い物にならない場合もあります。これらをクリアして初めて臨床試験に乗りますがフェーズ3と呼ばれる段階の臨床試験になれば、この効果が認められ、副作用も許容範囲内である新薬に対して、今まで行われてきた標準治療、つまり現状では最良の治療法とどちらが優れているか、比較することが行われます。
この試験でより優れるという結論が出た場合に、治療のガイドラインが変わり、それ以降はその新薬が標準治療になるわけです。これは世界規模で起こります。がんは人類に共通した疾患だからです。ですのでフェース3は医学の歴史そのものになります。
CDK4/6阻害剤もそのようにして、まずホルモン感受性HER2陰性進行再発乳がんの標準治療を書き換えてしまったお薬になります。PALOMA試験、MONARCH試験、MONALEESA試験という言葉が出てくるのですが、これはそれぞれパルボシクリブ(イブランス🄬)、アベマシクリブ(ベージニオ🄬)、リボシクリブ(キスカリ🄬)という薬に対して行われた臨床試験の略称になります。覚えやすいようにそう名前を付けるのですね。CDK4/6阻害剤の歴史はPALOMA-2というフェーズ3試験で始まりました。
イブランス+ホルモン剤がホルモン剤単独で治療した場合と比較してホルモン感受性HER2陰性進行再発乳がんのPFSを約2倍に延ばすことに成功したのです。これは衝撃的な結果です。副作用も好中球減少という白血球が減ること以外あまり強いものはありませんでした。そしてこれにより標準治療が変わることになりました。

さてここでPFSという見慣れない言葉が出てきます。これは”無増悪生存期間”という意味です。
このデータ、再発したがんに対する新薬や治療を研究した論文でよく使われる指標です。
ChatGPTにPFSについて聞いてみましょう。
PFS(Progression-Free Survival)とは、がん治療などの臨床試験や研究においてよく使用される指標の1つです。PFSは、特定の治療を受けた患者が病気の進行(がんの再発や増殖)なしに生存している期間を表します。
PFSは、治療の効果を評価するために重要な指標です。通常、がんの治療では、薬物療法や放射線療法などの治療が行われ、患者のがんの進行を遅らせるか、一時的に止めることを目指します。PFSは、治療が進行を遅らせる能力をどれだけ持っているかを示す指標として使われます。
PFSは、治療を受けた患者の状態を定期的に監視し、がんの進行が見られた場合にイベントとしてカウントされます。進行とは、がんの再発、新たな転移、または既存の腫瘍の増大などを指します。PFSの期間は、初めての進行イベントが起こるまでの時間を測定します。
PFSの利点は、がん治療の効果を早期に評価できることです。通常、生存期間全体を評価するよりも早く、治療の効果を知ることができます。また、臨床試験や研究において、新しい治療法の効果を比較するためにも使用されます。
ただし、PFSにはいくつかの制約もあります。進行イベントが生じた場合、その後の治療やケアによって患者の生存期間が延長される可能性がありますが、PFSではそれが考慮されません。また、PFSは進行を測定するため、治療によってがんの縮小や一時的な応答がある場合でも、それが反映されないことがあります。
総括すると、PFSは特定の治療法ががんの進行を遅らせる能力をどれだけ持っているかを評価する指標です。臨床試験や研究において、新しい治療法の有効性を比較したり、患者の治療計画を立てる際に重要な情報として利用されます。
満点の回答です。もう一つOS(Overall Survival:全生存期間)という指標があります。その違いを聞いてみましょう。
OSは、特定の治療を受けた患者ががん診断後に生存している期間全体を測定します。OSは、がんの治療やその他の要因による影響を総合的に考慮し、患者の全体的な生存期間を評価します。つまり、がんの進行や再発に関係なく、治療後の生存期間を測定します。
PFSとOSの主な違いは、測定する期間と評価する要素です。PFSは進行イベントまでの期間を測定し、がんの進行を遅らせる効果を評価します。一方、OSはがん診断後からの全体的な生存期間を測定し、治療やその他の要因による影響を総合的に考慮します。
両指標の使用は臨床試験や研究の目的に応じて異なります。PFSは治療効果の早期評価に役立ち、治療法の有効性を比較したり、治療計画を立てる際に重要な情報となります。一方、OSは治療後の全体的な生存期間を示すため、治療の長期的な効果や患者の予後を評価するのに適しています。重要なのは、PFSとOSは単独ではなく、相補的に使用されることが多いことです。治療法の有効性を総合的に判断するためには、PFSとOSの両方のデータを組み合わせて考慮する必要があります。
読んでくれていますか? (笑) 私のブログで最難関になるような気がしています(笑)。
ただこのPFSとOSの違いを分からずに、どんなに勉強し、英語の医学論文にまで手を出されたとしても、おそらく臨床における意味を理解できません。つまり自分にとってその薬剤がどんな意味を持つか、理解できません。
実はこの話 CDK4/6阻害剤を理解するのにとてつもなく重要になります。この解説をせずに本論に入れないのです。ご理解ください。


乳がんが再発したとき、もちろん様々な治療が行われます。
しかしその治療がたとえ効果があり、進行が止まったとしても、それで根治できない場合、再びがんの進行が始まることがあります。そうして一次治療という最初の治療の効果がなければ二次治療に移ります。
一次治療はその時最善と思われるものが選ばれます。つまり標準治療です。しかしやってみたら二次治療の方がより効果が高かった、ということはどうしても発生します。
でも一次治療がよく効いた方であっても二次治療は全くと言って効果がなかった、そうすると一次治療では効果がなく、二次治療でよく効いた方の方が最終的には長生きされたということが起こります。つまりOS(最終的に再発して何年生きられたか)では差が出なかったということが起こります。
対してPFSは再発したがんが再び大きくなり始めるまでの期間、つまり一次治療のみで効果を見るため、実際には後者の患者さんが長生きしていたとしても、前者の治療が優れていた、という結果になります。
薬の効果を見るだけなら別にPFSだけ見ていたらいいんじゃない、という考え方もあります。ただPFSでなく、OSで評価することはとても重要です。というのも一次治療は二次治療に影響することがあるからです。CDK4/6阻害剤を使うとホルモン感受性が失われやすいことがわかっています。つまり一次治療で効果が得られなくなればもはやホルモン剤は使えません。どうしても二次治療は抗がん剤になります。抗がん剤はホルモン剤による治療と比較して副作用が強く、どうしても長期間の治療が難しくなります。つまり最終的な生存期間が短くなる可能性があるのです。たとえ一次治療でよく効いても、それがホルモン感受性を失わせる効果があるのであれば最終的なOSが短くなる、ということです。患者さんにとっては最初のお薬が効くことも大事ですが、何よりもあとどれくらい生きられるか、それが最も重要になります。その薬だけよく効けばいいものではないのです。
「ぬか喜び」という言葉があります。日本語のことわざであり、物事が思いがけずに良い結果をもたらしたり、予想外にうまくいったりしたときに使われる表現です。具体的には、本来は喜ぶべきでないような状況や結果に対して、思わず喜んでしまうことを指します。
良い結果に出くわしたときに、驚きや喜びを感じます。しかし、その結果が一時的なものであり、長続きしないことを含んでいればぬか喜びだ、と言います。
そう考えれば、再発乳がんの治療を考える際にはPFSも確かに重要ではあります。しかしそれが「ぬか喜び」に過ぎないことを避けるために、OSの方が患者さんにとってはもっと重要な指標だ、と言えなくもないのです。
2023.07.06
このブログは再発患者さんのような、少し医学に知識があり、さらに納得いくまで新しい薬剤や、治療法について調べてみたいという方に向けて書きます。一般の方にはすこし難しいと思います。この題名を見て読みたいと思う方以外には勧めません。そして難しいので解説しながら進めますが、長くなりそうなので何回かに分けます。
現在 乳がんで治療を受けておられる方で、自分は発見された時から進行がんだとされ、術後にホルモン剤治療に加えてCDK4/6阻害剤と呼ばれる薬剤を併用されておられる方は多いかと思います。非常に高価なお薬なので、負担も大きく、これが本当に必要なのか、という疑問を患者さんからよく言われます。
ただそうしたお薬に関して本当に必要か?という疑問は我々医師ももちろん持っています。そして常に調べてもいるのです。
スカラリアという論文を整理する便利なフリーソフトがあります。日常的に論文を読まなければならない我々は以前は紙で論文を管理していました。そうするとあれはどこに行った、これに関する論文はどれだっけ、などいろいろ大変でした。いまは論文はすべてデータとして持っておき、PCで管理できます。ただ無料なソフトにはそれなりに理由があります。スカラリアはわれわれ医師がどんな論文に興味があるのか、そのデータを集めて吸い上げているのです。
そのスカラリアが6月分として乳腺領域で最も読まれているとした論文があります。それが下記です。
ホルモン受容体陽性、ERBB2陰性乳癌に対するサイクリン依存性キナーゼ4/6阻害剤:総説
O'Sullivan CC, et al: JAMA Oncol 2023
これは現在使用されているCDK4/6阻害剤 パルボシクリブ(イブランス🄬) アベマシクリブ(ベージニオ🄬) リボシクリブ(キスカリ🄬:日本では保険収載なし)について現状まででわかっていることをまとめた総説になります(以降🄬商標 省略)
この論文、リンクを追って見られればわかると思いますが、全文読むためには有料です。
よく読まれている論文はフリーアクセスと言って無料のことが多いのですが、これはそうではありません。お金を払っても医師はそれだけ読みたいのだということがわかります。
この3剤はここに書かれた順番で発売されており、最後のキスカリについては日本で保険未収載になっています。理論的には同じ機序でがんに対して働き、効果を示すはずですが、イブランスとベージニオだけでも使ってみると副作用からだけでも大きく使用感が異なっており、違う薬であることがわかります。
またこの2剤はホルモン感受性HER2陰性進行再発乳がんの治療として保険収載されているのですが、ベージニオは早期がんの初期治療においても保険適応となっています。イブランスはその適応はありません。したがって効果も異なることがわかります。
それはいったいなぜなのか、どういったところからきているのか、それをたくさんの論文から読み解くのは大変なので、みんなそれをまとめてくれているこの論文を読んでいるのです。

Cyclin Dは、細胞周期の制御に重要な役割を果たすタンパク質の一種です。細胞周期とは、細胞が成長、DNA複製、そして分裂する一連のプロセスを指します。
Cyclin Dは、G1期と呼ばれる細胞周期の最初の段階で重要な役割を果たします。G1期では、細胞は成長し、DNAの複製に備えます。Cyclin Dは、細胞がG1期を進行し、S期(DNA複製期)に進むためのスイッチとして機能します。
具体的には、Cyclin DはCDK(サイクリン依存性キナーゼ)と結合します。CDKは細胞内に存在しているタンパク質キナーゼであり、特定のタンパク質にリン酸基を付加することで細胞内のシグナル伝達を制御します。
Cyclin DとCDKが結合することで、CDKの活性が高まります。この活性化されたCDK-Cyclin D複合体は、細胞内の他のタンパク質に対してリン酸基を付加し、細胞周期の進行を制御します。
具体的には、Cyclin D-CDK複合体は、Rbタンパク質と相互作用します。Rbタンパク質は、細胞周期を進行させるための特定の遺伝子の発現を抑制しているタンパク質です。Cyclin D-CDK複合体がRbタンパク質にリン酸基を付加することで、Rbタンパク質は不活性化され、遺伝子の発現が解除されます。
このようにして、Cyclin Dの存在によって、細胞はG1期からS期へと進行し、DNAの複製を行うことが可能になります。細胞周期の進行は、このようなCyclin D-CDK複合体の形成と活性化によって厳密に制御されています。
なお、Cyclin Dは細胞周期の他の段階においてもさまざまな役割を果たしますが、G1期におけるDNA複製への進行の制御が特に重要な働きとして挙げられます。
まずCDK4/6阻害剤のイメージをしましょう。
上の図は細胞分裂を車輪の回転にたとえたものです。がん細胞ではこれが無秩序にどんどん回転しています。左の図の回転がそうです。G1→S→G2→M→とぐるぐる回っています。自転車の後輪です。
そしてそれを加速させているものがいます。それはCyclinと呼ばれるタンパクで、ここではCyclin DとEを示しました。このタンパクが働くにはCDKというタンパクが必要です。それぞれCDK4/6、CDK2と呼ばれます。CDK阻害剤はここをブロックすることで加速している細胞分裂を止めようとする薬です。Cyclin DはD1とD2に分かれ、D1をCDK4、D2をCDK6が担当します。
CDK4/6阻害剤は、細胞の成長と分裂の重要な調整因子であり、細胞周期の G1 期から S 期への移行を制御します 。 Cyclin D1 の高発現はホルモン感受性のある乳がん細胞の主要な特徴であり、予後不良およびホルモン剤への抵抗性と関連しています。CDK4/6阻害剤は、その重要な調節因子です。
もちろんCDKを阻害する薬剤の開発はずっと行われてきました。しかしCDKのすべてを阻害しようとする薬剤の開発は、初期には骨髄抑制、胃腸、肝臓への強い毒性によって失敗しました。副作用が強すぎるのです。
しかし、イブランス、キスカリ、およびベージニオは、許容範囲内の毒性でCDKを抑制することに成功しました。
イブランスはCyclin D1/CDK4およびサイクリン D2/CDK6 に対して同程度の効力を持っていますが、ベージニオとキスカリは CDK6 よりも CDK4 に対して強力な効力を持っています。 ベージニオは、CDK1、CDK2、CDK5 など、他の複数の酵素も阻害します。その分効果も、そして副作用も他とは異なります。
印象としてやはりベージニオの毒性はイブランスより高いように感じられます。しかしその分ベージニオは進行再発乳がんだけではなく、早期乳がんであっても再発リスクの高い乳がんに対して効果を示すことがわかっています。
2023.06.16
乳がんは早期発見されればまず治癒します。
この言葉当たり前と言えば当たり前ですが、かなりインパクトのある言葉です。
がんと診断されれば誰でも”死”が眼前を横切ります。それはたとえ早期だと言われてもそうでしょう。しかも診断された当時にはどの医者も早期です、と断言してくれません。早期として診断が確定するのは最低限、転移の有無についての検査が終わらなければならず、できれば手術を含めて治療が完了した段階で病理学的な病巣の大きさ、リンパ節転移の有無が診断され、それから早期であったかどうか最終決定されます。
がんと診断された日からおそらく1か月以上経過していることでしょう。その間はたとえ先の言葉を信じることができたとしても不安は消えないはずです。それでも乳がんは”早期発見されればまず治癒します”。そしてもし貴方のがんが検診で発見されたのであれば当然早期である可能性が高く、そしてそれは治癒する可能性が高い、と考えていいと思います。
今年 2023年4月 C. Taylor先生が英国50万人の早期乳がん、1993年から2015年の観察研究を行いその結果を発表しました。(BMJ 2023;381:e074684 | doi: 10.1136/bmj-2022-074684)
ここでは早期乳がんはDCIS(非浸潤性乳管がん)を含んでいないことに注意してください。つまりStage 0を含まないStage Iの方を調査した結果になります。
そしてもう一つ重要なことは、この早期がんの定義は最終診断ではなく、乳がんが発見された時に早期がんとされた方を調査していることです。したがって最終的には2cmを超えていたり、リンパ節転移があった、つまり最終的には進行がんとされた方を含んでいます。ですので、がんが発見された際にあなたは今の段階では早期がんと思われます、と言われた方が対象の調査になるのです。
たとえば今回の観察結果では、診断時に、60歳の女性で、スクリーニング検査で腫瘍、サイズ<20mm、低悪性度、エストロゲン受容体陽性、HER2陰性、リンパ節陰性が検出された場合の推定5年間の乳がん死亡リスクは0.2%でした。1000人に2名以外の例外を除けば助かります。これは普通に考えて60歳の女性が65歳になれる確率はもともと100%ないわけで、ほぼ無視できる数値と言えるのではないでしょうか。
つまりまず治癒する、と言えると思います。
「え、条件があるの?」と思われたかもしれません。
そのとおり。確かに早期乳がんで発見されても注意が必要な”タイプ”のがんはあることもわかりました。でもまず治癒するといえるがんもわかっているので、皆が同じように心配する必要はない。上記の条件は医学的表現ですが、皆さんにわかりやすいように言うならば、「閉経後、検診で発見されて早期ですと言われた乳がんで、抗がん剤は不要ですとなり、術後にホルモン剤を飲んでおられる方は、まず1000人2人も亡くなりません」とこうなります。かなり端折りましたが。

こうした方が、再発を気にして乳腺外来に足しげく通い、腫瘍マーカーやPET、CTなど転移の検索を定期的に受けていくのは何とも無駄に思えます。もしその状況で、現在増加している大腸がんや、今でも致死率の高い肺がんの検診をしていないとするなら、それは本末転倒です。
もちろんPETやCTで大腸がん、肺がんも見つかるときは見つかります。しかし早期で発見できるとは限りません。すべての種類のがんを一度の検査で早期発見できる検査方法はまだありませんので、ドックを受けるなり、それぞれ考えていく必要があると思います。
私が言いたいのは、乳がんはまず治癒している、とされる方が、再発を気にするあまり、再発の検索ばかりして、他の部位のがんの早期発見のための検診をおろそかにしたのでは本末転倒だ、とお話ししているのです。時間もお金も貴重なのですから効率よく検診していくべきです。
Taylor先生は、この50万人の早期乳がん患者さんを、1993から99年に診断された方、2000から04年の方、2005から09年 そして 2010から15年の4つの期間に区切りました。
1993から99年に診断された方は5年で14.4% (95% CI 14.2% to 14.6%)の方が亡くなっていました。これの数値は年を追うごとに下がって2010から15年に診断された方は5年で4.9% (95% CI 4.8% to 5.0%)まで下がっていました。逆に全体で95%、つまり現在であれば早期がんであるとされれば20人に19人は5年後も生存されていることになります。
さらに同じ早期乳がんであっても、検診で発見された早期乳がんは、自分で発見された早期乳がんよりも予後は良好でした。これは5年生存率でみて、亡くなる方の割合でほぼ2倍の差異がありました。ただどちらの群でも年を追うごとに改善していました。具体的な数値は示されていませんが、グラフから読み取れる数値として、50歳から64歳で、検診で2010年から2015年に発見された場合の早期乳がんで5年後に亡くなっている可能性は2%前後、検診で発見されていない場合は6%前後でした。ちなみに1993年から1999年発見の方であれば、それぞれ7%、14%程度ありました。
同じ早期がんであっても差が出てしまう原因は、この調査は”診断時に早期がんとされた”方が対象だからです。最終的に手術をしてみたらリンパ節転移があった、つまり早期ではなかった。こうした症例の割合は検診発見の方に比べてどうしても高くなります。それが影響した可能性が高い。
逆に、検診で発見され、早期がんです、と言われた。その場合は真の早期がんである可能性が高い、となります。その場合は本当に治癒する確率は高くなります。
それ以外の要素として
ホルモン剤に感受性のある方はない方よりも予後は良好でした。
組織学的に異型度の高い方は低い方よりも予後は不良でした。
年齢が若いほど予後は不良でした。
リンパ節転移の有った方では数が多いほど予後は不良でした。
乳癌のサイズが大きいほど予後は不良でした。
しかしそのすべてにおいて、1993年から1999年発見の方に比較して、2010年から2015年に発見された方まで、現在に近いほど予後が改善していました。これはその論文のグラフを見ていただければと思いますが、ほぼすべての群で、5年後に亡くなっておられる方は半分から4分の1まで減っているといえます。
特にHER2陽性の方の予後は劇的に改善していました。これはハーセプチンを含めて分子標的治療の普及が大きな役割を果たしていると思います。
これらを総合すれば
乳癌発見時に、それが検診発見であり、早期がんと診断され、閉経後で、ホルモン剤が用いられ、抗がん剤は不要とされたような方では、まず治癒する時代が来ている、となります。
共著者であるテイラー氏と患者擁護者としてこの研究に参加した乳がんサバイバー2名の意見が同じ雑誌に掲載されていました。
彼女らは、「乳がんの予後は、この研究で記述された危険因子によって大きく異なることを、医師は患者に伝えなければならない」と強調しました。
「自分が20年前に乳がんと診断されたとき、これは深刻で早急に治療する必要があるという事実以外、予後については何も告げられませんでした」と患者擁護者のマイリード・マッケンジー氏は思い出します。
「しかし、予後についての適切で明確なコミュニケーションは、患者の生活の質と、患者がどのように物事に対処できるかに大きな違いをもたらす可能性があると思います。」
「大多数の女性の予後は良好です」と彼女は続けます。「この研究はそれを裏付けており、安心感を与えてくれます。なぜなら、どのように早期で発見されたとしても、乳がんだと診断された時、最初 誰もが自分は死ぬのだと思うからです。」
このブログを読まれている方は乳腺には個人差があり、同じようにマンモグラフィで検診を受けられたとしても、その乳腺の”濃度”の違いによって乳がんを発見する”しやすさ”に差があることをご存じだと思います。(高濃度乳腺とは ーAre You Dense?ー)
また同じようにご家族の血縁者、母親や、娘、叔母などに乳がん患者さんがおられる方では遺伝的な要素によってそれ以外の方よりも乳がんに罹患されるリスクが高いこともまたご存じだと思います。(遺伝性のがんという概念)
以前も一度 高濃度乳腺、つまり乳腺の濃度が高い方は乳がんに罹患しやすい、リスクの高い方である、という話をしましたが、最新のデータとしてJAMAという雑誌に、皆さんは意外と高濃度乳腺そのものががんのリスクであることを知らない、という事実が発表されていたのでここで紹介したいと思います。
それぞれリンクを貼っておきますので、そちらもぜひ目を通していただければ幸いです。
まず米国では州によって違いはありますが、ほとんどの州で乳腺の検診を受けられた女性に、乳腺の密度(濃度)を知らせることが法律で決められています。これはたとえば密度が高ければ高い女性であるほど、マンモグラフィ検診で乳がんを見つけることが難しくなるからです。
別の言い方をすれば、乳腺密度が高い方は、マンモグラフィ検診を受けて”異常なし”と診断されても、安心はできないということになります。これは”見落とし”とは異なります。砂浜で石を探すことと、河原で石を探すことの違いです。もともと見えない検査で見えないものを探している結果です。
ですので、乳腺密度の高い方は検診を受けても乳がんが見つかりにくい。これは事実です。
ただ乳腺の密度が高い女性は、もちろん乳腺が”多い”ことになるので、乳腺に発生する乳がんのリスクもまた高くなる。これは検査が難しいこととは別の問題です。乳腺密度が高い方は、乳がんに罹患するリスクも高く、それでいながらその乳がんをマンモグラフィ検診で見つけることもまた難しい、このことを見落としている、あるいは知らない方は多いことがわかりました。
調査を完了した 2306 人の女性のうち、
1,706 人の女性 (93%) が、家族に乳がんの方がおられることの方が、乳腺密度が高いことよりも乳がんリスクは高い、と見なし、1,188 人 (65%) が過体重または肥満であることが乳腺密度が高いことよりも大きなリスクである、と感じていました。
子供を産まない ことの方が、乳腺密度が高いことよりも乳がんのリスクは高いと考えている人は(957 [52%])、1 日に 1 杯以上のアルコール飲料を飲む (975 [53%])、以前に乳房生検を受けたことがある (867 [48%])人は、乳腺密度が高いことよりも乳がんのリスクは高いと考えていました。
過去にも同様の結果が出ています。多くの女性が、乳腺密度が乳癌リスクに与える影響について依然として過小評価していました。

このようにジャーナル JAMA Network Open で発表された調査によると、参加した女性のうち、大多数が家族歴よりも乳房密度を重要な危険因子と見なしていませんでした。
しかし、研究によると、脂肪組織が最小限であることを特徴とする非常に密度の高い乳房を持つ女性は、乳房密度が最も低い女性よりも乳がんのリスクが 4 倍高くなります。(”きわめて高濃度”と記載されている方がそれにあたります。)
マンモグラムを受ける女性の約 10% は、このレベルの乳房密度を持っています。
対照的に、母親、姉妹、または娘が乳がんを患っていた場合、乳がんのリスクは 2 倍になります。
研究によると、かなりの量の高密度乳房組織を持っているが、極端な程度ではない女性 ( マンモグラムを受ける女性の約 40%) は 、平均的な乳房密度を持つ女性と比較して、乳がんのリスクが 20% 高くなります。(”不均一高濃度”と記載されている方です。)
まとめると乳腺の密度は2つの点で重要です。
乳腺の密度が高いこと=乳腺の量が多い=乳がんに罹患するリスクが高いことにつながります。
乳腺の密度が高いこと=マンモグラフィで乳がんを見つけることが難しい
日本ではまだ検診を受ける女性に乳腺密度を知らせることが義務化されていません。
マンモグラフィ検診を受けた際にはご自身で気を付けて、ご自身の乳腺密度を知っておくことが重要になります。ブレストアウェアネスの考え方です。


2022.12.02
権威と言われる雑誌に掲載された論文を信じてしまうのはわれわれ学者のわるい癖ですが、医学においても最高権威の一つであるNew England Journal of Medicineに、2022年11月 更年期障害における症状のひとつであるホットフラッシュに有効な薬剤が開発されたニュースが掲載されました。
Lancet (London, England). 2022 11 12;400(10364);1704-1711. pii: S0140-6736(22)01977-8.
”乳がんの治療において、タモキシフェンや、アロマターゼ阻害剤など、補助内分泌療法を受けている乳癌女性の 3 分の 2 以上が、血管運動症状 (のぼせや寝汗) を経験しています。にもかかわらず安全で効果的なこれに対する治療法が不足しています。Q-122 は、視床下部のエストロゲン応答性ニューロンを調節することにより血管運動症状を軽減する見込みがある、新規の非ホルモン化合物です。経口補助内分泌療法を受けており、ホットフラッシュをはじめとする血管運動症状を経験している乳がんの女性におけるQ-122の有効性と安全性を評価しました。”
この論文の最初のイントロダクションですが、ここで気になる一文があります。
”安全で効果的なこれに対する治療法が不足しています”とあります。論文原文では"lacking”と書かれており、わたしは不足という訳をあえて当てましたが、ニュアンスの問題とはいえ、筆者はおそらく不足ではなく、”欠けている”と言っています。
日本ではすでに漢方薬をはじめとして、市販されているサプリメントも存在しており、それを飲んでおられる方も多く、さらにそれで効果があったといわれている方もおられるので、あえて不足と訳しましたが、安全かつ効果が証明されている薬剤はなかった、ということが実際なのでしょう。
(ここは難しいので適当に読み飛ばしても結構です)
”オーストラリア、ニュージーランド、米国の 18 か所で、多施設、無作為化、二重盲検、プラセボ対照、概念実証、第 2 相試験を実施しました。
適格な参加者は、18〜70歳の女性で、乳がん後に安定した用量のタモキシフェンまたはアロマターゼ阻害剤を服用しており、中等度から重度の血管運動症状を週に少なくとも50回経験しています。
参加者は、インタラクティブな Web 応答システムを使用して、1 日 2 回、28 日間、Q-122 100 mg の経口投与または同一のプラセボに無作為に (1:1) 割り当てられました。無作為化は BMI (≤30 kg/m 2または >30 kg/m 2)および選択的セロトニン再取り込み阻害剤、選択的ノルエピネフリン再取り込み阻害剤、ガバペンチン、またはプレガバリンのいずれかを使用してそれを層別化しています。
Q-122 カプセルとプラセボ カプセルは外観が同じで、容器のラベルも同じでした。二重盲検の治療および分析段階では、参加者、治験責任医師、臨床研究機関のスタッフ、およびスポンサーは、治療の割り当てについてマスクされていました。
主要評価項目は、28 日間の治療後の Q-122 とプラセボとの間の中等度および重度のほてりおよび寝汗の血管運動症状重症度スコア (msVMS-SS) のベースラインからの平均変化率の差でした。一次分析は、修正された治療意図によって行われ、安全性は、治験薬の少なくとも1回の投与を受けたすべての参加者で評価されました。”
本試験のデザインについて言及しています。
ここで重要なのは、この新しいQ-122という薬剤を飲む方と、プラセボ(見た目はそっくりで、薬理作用のないたとえばでんぷんなど)を飲む方、の2群にランダムに(誰かが意図的に分けるのではなく、サイコロを振るようにして分ける)振り分け、比較したというところです。
この薬を飲んだのは28日間とのことですが、この間、患者さんはもちろん、医師や看護師、薬剤師のだれもが、Q-122を飲んでいるのか、でんぷんを飲んでいるのか、知らされていない、という点が重要です。これを二重盲検比較試験と呼んでもっとも信頼性が高い方法です。
なぜプラセボを使うのか?
それはこれに続く結果を読めばわかります。そうです、でんぷんを飲んでいるだけなのに、ホットフラッシュが改善した人がおられるのです。実はプラセボ効果とも呼ばれるこの現象はいまでも医学の謎の一つです。思い込みだろう、と言われる方もいるのですが、プラセボで実際に血圧も下がります。便秘が解消します。感覚だけではなく物理的生理的な変化が生じるのです。人は思い込みで自分の体を変化させられるのもまた事実なのです。ですので、こうした患者さんの主訴が改善するかどうか検証する研究ではプラセボを用いて比較することが必須とされます。


2018 年 10 月 24 日から 2020 年 9 月 9 日までの間に、ホットフラッシュのある243 人の患者がスクリーニングされ、そのうち 131 人がランダムに本試験に割り当てられ、治療を受けました (Q-122 n=65 および プラセボ n=66)。
Q-122 は、プラセボと比較して、28 日間の治療でベースラインからの msVMS-SS の平均変化率が有意に改善しました ( Q-122で–39% vs プラセボは–26% p=0·018)。
治療に起因する有害事象は一般に軽度から中等度であり、2 つのグループ間で同様でした。
治療に関連した治療に起因する有害事象は、Q-122 群の患者 65 人中 11 人(17%)vs プラセボ群では 66 人中 9 人(14%)です。
Q-122 群の患者は 0 人、プラセボ群の 2 人 (3%) の患者に重篤な有害事象がありました。
これが結果です。症状が改善した方が39%で、プラセボを飲んでおられる方よりも有意に多かった、という結論です。正直、大したことないな、と思われた方も多いのではないでしょうか?
そして驚くべきことにプラセボでもなんと26%も改善している。どうでしょうか。
逆にとって、更年期症状は、考え方によっていくらでも症状は改善しそうな気がしますね(男性の私がこれを書いてしまうと叱られますけれども)。
Q-122がいくらの値段になるかはまだわかりませんが、今後日本でも臨床応用されるかもしれません。ホットフラッシュに苦しんでおられる方にはたしかに朗報でしょう。
ただ今回のプラセボによって得られた結果もまた重要な気がします。
私は更年期障害を訴えられる患者さんにはまずは運動を勧めています。それも週に何回でもいいからホットヨガや、軽いジョギング、縄跳びなど ”汗が出る”運動を勧めています。普段から汗をかいていれば、それ以外の時に汗が出ても、気になりにくくなります。男性の私が行っても説得力がないかもしれませんが、女性の方に聞いて確認しています。そしてなにより体に良くても悪いことは一つもない。
ですので、薬を飲むよりまず先に試してほしいのです。
運動でホットフラッシュは軽くなる、信じることで、少なくとも26%の改善効果は最低限あるはずですよね。でんぷんでもそうなのですから。
2022.11.24
この記事は”センチネルリンパ節生検”の言葉が理解できる方向けの記事になります。
たとえば乳がん腫瘍が皮膚や筋肉には及んでおらず、術前の診断ではリンパ節転移はないと診断された患者さんでは、腋窩廓清を省略できる可能性があることから、最近ではセンチネルリンパ節生検(代表的なリンパ節を数個調べて陰性であればよしとする考え方)を施行し、陰性とされれば腋窩を廓清しない、という方法がとられます。
それでも結果として陽性である場合ももちろんあり得ます。ただもちろん術前には陰性と診断していたのですから、それほどひどい状況で転移しているとは考えにくい。転移があったのは調べたリンパ節だけかもしれない。そうした際に腋窩放射線療法 (ART) は、腋窩リンパ節郭清に取って代わることができるでしょうか? ちなみにリンパ節転移があれば、乳腺をたとえ全摘したとしてもどちらにしても放射線治療がなされることが多い。とすればこの考え方はどうせ放射線治療をするなら、もう腋窩に手術を加えなくてもいいのではないか、とする考え方です。Bartels先生らによって研究されました。
Bartels SAL. Radiotherapy or Surgery of the Axilla After a Positive Sentinel Node in Breast Cancer: 10-Year Results of the Randomized Controlled EORTC 10981-22023 AMAROS Trial. Journal of Clinical Oncology. 2022.

対象患者さんは 2001 年 2 月から 2010 年 4 月まで含まれていました。 本試験(AMAROS 試験)では 4,806 人の患者が センチネルリンパ節生検を受け、1,425 人がリンパ節陽性でした。腋窩リンパ節廓清群(ALND) (n = 744) または腋窩放射線治療群=手術は施行せず(ART) (n = 681) にランダムに割り当てられました。追跡期間の中央値は 10.0 年 (8.4 ~ 10.3 年) で、両治療群で同等でした。
腋窩再発率
腋窩の残ったリンパ節から再発する腋窩再発は、ALND 後の患者 744 人中 7 人 (0.9%)、ART 後の患者 681 人中 11 人 (1.6%) で発生しました。10 年間の累積発生率は、ALND 後 0.93% (95% CI 0.18 ~ 1.68)、ART 後 1.82% (95% CI 0.74 ~ 2.94) (HR 1.71; 95% CI 0.67 ~ 4.39) でした。それぞれ3人と5人の孤立した腋窩再発がありました。合計で、5 ~ 11 年の追跡調査の間に8人のイベントが発生しましたが、腋窩再発の数がそもそも少ないため、あまり統計的な意味はありません。
(筆者注:手術の方がわずかで再発が少なく出たのはそれでもうれしいです。ただ結局腋窩のリンパ節転移は、それ自体でその方の命を奪うのではなく、後に他の臓器から転移が見つかり、再発する、そのことによって生命に脅威になることがよくわかります。結局腋窩リンパ節は転移があったとしても、手術にせよ、放射線治療にせよ、ほぼすべて処置されているわけですから。)
全生存率および無(病)再発生存率
ALND グループでは 104 人 (14.0%) が死亡し、ART グループでは 112 人 (16.4%) が死亡しました。乳がんによる死亡は、ALND グループの 65 人 (8.7%) の患者と ART グループの 70 人 (10.3%) の患者で発生しました。10 年 OS 率は、ALND グループで 84.6% (95% CI、81.5 ~ 87.1)、ART グループで 81.4% (95% CI、77.9 ~ 84.4) でした (HR、1.17; 95% CI、0.89 ~ 1.52; P = .26;図 2)。10 年 無(病)再発生存率 率は、ALND グループで 75.0% (95% CI、71.5 ~ 78.2)、ART グループで 70.1% (95% CI、66.2 ~ 73.6) でした (HR、1.19; 95% CI、0.97 ~ 1.46; P = .11)。
(筆者注:これも手術の方がわずかでも再発が少なく、生存率が高く出たのは統計的な差がないとしてもうれしいです。)
罹患率とQOL
すべての測定時点で ART 後よりも ALND 後の方がリンパ浮腫が観察されました。
リンパ浮腫の治療される頻度が有意に高く、術後1年での発生率が最も高い。全体として、ALND 後患者の 44.2% が、ART 後の患者の 28.6% と比較してリンパ浮腫を報告しました。少なくとも 10%以上の腕周囲の測定値の増加が、ALND 後により頻繁に測定されました。肩の可動性は2つの治療群で同様でした。QoL については、治療後 1 年、3 年、および 5 年で、選択されたスケール (腕の症状、痛み、または身体イメージ) のいずれの間にも統計的差異は観察されませんでした。腕の症状スケールの2つの項目で、統計的に有意な差が観察されました。ALND 後には腕/手の腫れがより多く報告され、ART 後には腕を動かすのがより困難になったと報告されました。これらの値は臨床的有意性に達しませんでした。
(筆者注:結局アンケートをすれば、それほど差がないものの、測定値も治療になる方も、手術を受けた方の方で、リンパ浮腫が多くなることは明らかになっています。ほぼ倍であることはショックです。)
探索的分析(から抜粋)
二次原発がんは、ALND (57 件) と比較して、ART (75 件) 後に有意に多く発生しました。10 年累積発生率は、ART 後 12.1% (95% CI 9.6 ~ 14.9)、ALND 後 8.3% (95% CI 6.3 ~ 10.7) (HR 1.45; 95% CI 1.03 ~ 2.04; P =0.035) )。これらのイベントのうち、21 件 (28%) は ART 後の対側性乳がんまたは上皮内乳管がんでしたが、ALND 後の 11 件 (19%) でした。二次原発がんは、ART 後の 22 人の患者と ALND 後の 16 人の患者の死因でした(データ補足)。
(筆者注:外科の見方の筆者にすれば、よかった、となりますが、不思議なデータです。放射線治療をしている方が、二次、つまり異時性に発生する乳がんは少ないかも、と考えていたのです。ちょっとでも対側にも放射線治療が当たりそう?そんなことはないですが・・・むしろそのためにがんが引き起こされた、この論文の筆者も少し考察されていました。しかしこれは偶然と考えます。ただこの結果を除けば、わずかに手術群でよかった生存率も差がないという結果になりそうです。)
AMAROSから導かれる結論
術前に様々な検査で腋窩リンパ節転移はないとした症例は、たとえ術中に陽性と診断されても、それ以上方針を変更して手術を大きく腋窩にまで広げることは必要ない、となりました。ただリンパ浮腫を起こすだけだ、となります。
ただこの論文にはいくつか疑問があります。まずリンパ浮腫の頻度です。どの程度でそう診断するかにもよると思いますが、術後の44.2%は“高すぎ”です。ほぼ半数がリンパ浮腫になる、どんな手術をしているのか、と思います。リンパ浮腫が2倍なのにもかかわらず患者さんへのQOL調査では差がなかった。つまり検査してはじめてわかるようなリンパ浮腫まですべて含めたのでしょう。原則患者さんが気づきもしないようなリンパ浮腫を見つけることにあまり意味はないように思うのですが。
ただこの論文で気になるところはセンチネルリンパ節生検では1-2個しかリンパ節を検査しません。転移があっても、それ以上手術を拡大しないとなれば、たとえば転移したリンパ節が1個見つかった、しかしもしかすると2個3個とそれ以上あるかもしれない。それはわからなくなる、ということです。
今 日本のガイドラインでは腋窩にリンパ節転移が4個以上あれば、乳房をたとえ全摘していても放射線治療を行うことを標準とする、1個から3個であっても放射線治療を行うことを“弱く”勧める、とされています。転移個数で違うのです。
また乳房温存手術後は、センチネルがどうであれ、放射線治療を行うことが標準とされます。ややこしいですね。
だから私はこのように応用すればいいのではないか、と考えます。
まず術前検査でリンパ節転移がないと診断される症例がセンチネルリンパ節生検の適応となるのであり、腋窩リンパ節転移がたとえ陽性であっても、そこに転移範囲がとどまる可能性の高い症例が対象となることを前提に、
・温存切除で、センチネルリンパ節が陽性であればそれ以上廓清しない、ただし腋窩も放射線治療範囲に含める。
・乳房全摘で、センチネルリンパ節が陽性であれば、放射線治療になることを考慮して、少なくともリンパ浮腫に配慮して周囲リンパ節を最低5個程度までサンプリングしておき、後の治療の参考とする。ただ手術で根治を目指すような、いわゆる根こそぎ切除は必要ではない。転移があれば放射線治療になり、追加廓清に意味はない。逆に転移がなければ追加廓清する必要はない。
2022.10.28
近年の抗がん剤の進歩は素晴らしく、たとえ進行して見つかった乳がんであっても、大幅に縮小させることができたり、場合によって画像上は抗がん剤治療後に消失してしまったりすることも珍しくなくなりました。
がんの種類によって、化学治療を行う必要がある、と判断されれば、手術に先行して化学治療を行うことで、抗がん剤が効くかどうか直接的に判定でき、さらに効いてくれれば手術の規模を小さくすることもできる可能性があります。
比較的早期のHER2陽性またはトリプルネガティブ乳がん(TNBC)に対して術前化学療法を施行し、少なくとも画像で確認する限り、がんが消えてしまったように見える際に、患者さんから手術は必要なんですか?と尋ねられることもよくあります。
こうした際に私は「画像上は消えて見えても細胞1個まで消えているかを判断する検査がありません。ですので、もともと腫瘍があったと思われる部位は切除して、がん細胞が残っていないかは確認しておく必要があります。」と説明していました。
ただこの説明は少し矛盾をはらみます。もしその理屈が成り立つのであれば、
乳がん検診を受けて“異常なし”としていることはどうなのか?細胞1個のがんを見つける方法がないのなら、異常があるかもしれないではないか。それを確認するには乳腺をすべて切除しないといけないなら、検診は成り立たないではないか?
さらにいえば、針でついて病理検査をして悪性所見なし、と診断された。でもそれは先の理屈から言えば成り立たないではないか?針で突いただけで、みえる腫瘍のすべてを採取しなくても、がんではない、と診断できたではないか?それは矛盾していないか?
そこで、最近 こうした術前化学治療を施行し、画像上がんが消失している患者さんに対して、もう一度、がんがあった部分に針生検を施行し、少なくとも撮った標本上は病理学的にがんは消えている(病理学的完全奏効(pCR)といいます)ことが証明された場合、手術を受けないでいるとどうなるか、臨床試験が行われ、その結果が公表されました。
今回のお話は専門的なので、興味がある方のみ読んでください。
MDAndersonがんセンター Henry M Kuerers先生のお仕事です。
まず術前化学治療にて画像上がんが消失した50 人の患者さんのうち、 31 人 (62%) の女性において、US-VAB(いまもっともしっかりとした病理検査ができる針生検方法です。その分大量に組織が切除されます) 病理学的にがんが残っていないと診断されました。
その31人全員が、手術を施行せず、標準的な全乳房放射線療法を受けました。
追跡期間の中央値 26.4 か月後(平均2年間の経過観察をして)、手術を施行しなかった患者さんで乳房内の乳がん再発はありませんでした。

・もともと術前化学治療後、手術による乳房切除を施行して、その標本内にがんが残っていなかった場合(pCRが達成されていた場合)は、それ以外の症例に比較して予後がいいことがわかっていました。つまり手術で切除されなかった部位にがん細胞が残っており、それがのちになって出現するのが再発であるので、乳房内でがんが消えるくらいであればその他の部位のがんも消える、消えない場合は他の部位のがんも消えない、と言えるのです。
ですので、明らかにがんがあったはずの部位を、化学治療後に針生検してがんが消えて入れば、ほぼ全部消えた、としていいのではないか、という考え方が生まれます。
・乳癌の全身療法の進歩により、早期 TNBC および HER2 陽性乳癌の 60% 以上で pCR を達成できる化学療法の投与方法がそれぞれ開発されています。
・研究デザインにおける 3 番目の重要な要因は、US-VAB の使用でした。標準的な生検技術を採用した予備研究では、6つの標本が得られましたが、これでは不十分であることが判明し、容認できない率の偽陰性結果につながりました(がんは残っていないとされたのに、実は残っていた)。US-VAB を使用すると、研究者は 12 個の生検標本を得ることができ、精度が向上しました(がんが本当に残っていないときに残っていないと診断できる確率)。
研究の詳細
Kueer らは T1-2 N0-1 M0 疾患の 58 人の患者を評価し、そのうち 50 人が術前化学治療、そしてその後にUS-VABを受けた。対象は21 人の TNBC 患者と 29 人の HER2 陽性乳癌患者で構成されていた。
術前化学治療を完了した後、患者はマンモグラフィーと乳房の超音波検査を受け、放射線科医は US-VABに最適な方法を模索しつつこれを施行し、最低 12 個の標本を得ている。がんが残っている可能性があれば、手術を容易にするため、検査の際に腫瘍床にクリップを配置した。
主要評価項目は、術前化学治療後の US-VABで残存腫瘍が認められなかった女性における、6 か月後および 1、2、3、5 年後の再発率でした。50人の患者はすべて女性で、年齢の中央値は62歳でした。治療前の平均最大腫瘍サイズは2.28cmでした。
術前化学治療後のUS-VAB検査で、19 人の患者に残存病変があることがわかり、この方々は通常通りの手術を受けられました。
pCR の割合は、TNBC で 71% (患者 21 人中 15 人)、HER2 陽性乳がんで 55% (患者 29 人中 16 人) でした。ホルモン受容体 (HR) 陽性/HER2 陽性の 18 人中 7 人 (39%) の患者が pCR を示したのに対し、HR 陰性/HER2 陽性の腫瘍では 11 人中 9 人 (81%) でした。
TNBC および HER2 陽性の乳がんは、全乳がんの約 35% を占めています。この研究の有望な予備結果が、はるかに多くの ホルモン感受性陽性患者集団に適用されるかどうかは、まだ分からないと Kuerer 氏は述べています。ホルモン感受性陽性乳がんは、術前補助ホルモン療法を含む術前補助療法に対する感受性が低く、pCR は TNBC および HER2 陽性腫瘍と比較して発生頻度が低くなります。
早期HER2陽性またはトリプルネガティブ乳がん(TNBC)に対する術前化学治療に対する病理学的完全奏効(pCR)後に手術を受けないことを選択した女性は、追跡調査の最初の2年間で再発がなかったことが、小規模な前向き研究で示されました。
2 年間のフォローアップは結論付けるには短いですが、TNBC および HER2 陽性の腫瘍は早期に再発する傾向があるため、短期であっても再発がないことは重要な意味があるといえるでしょう。
ただこの研究では、患者は慎重に選択され、専門のセンターで治療を受けました。
手術をしないという結果が乳がん患者の一般集団に適応されるにはまだ早急な段階であることに注意が必要です。「これは非常に有望で非常に励みになると思いますが、一般病院で対象患者すべてに適応するには準備が全くできていないことは間違いありません」と Attai 氏は付け加えました。
2022.10.10
先日のピンクリボン講演会にご参加いただいた方、また聴講してくださった方ありがとうございました。
まずは御礼申し上げます。
自分が企画にあたって最初に意識したのは、もともと検診に興味がない方に、受けたこともない方に、いかにして興味を持ってもらうのか、そして受けようと考え始めていただくのか、そのきっかけをどうしたら作れるだろう、その点でした。
ただ検診を受けようと思い立っていただいたとして、今年受けてみられたとして、それきり興味を失ってしまっては意味はありません。検診はできるだけ規則正しく受けてくださらなければ意味はないのですが、それは検診を受けたことがない、興味もない、そんな方にとってはるか先の目標です。
そこでまず自己検診をしてほしい、と訴えることから始めようと思いました。
ただ今回の講演を聞いてくださるような方はもともと検診は受けておられるし、興味も持っておられます。定期的に検診されている方も多いことでしょう。そして意外ですが、検診を施設で受けているのだから、自分は自己検診しなくてもいい、そう考えておられる方は多いのです。
その方々にまず自己検診の意味、意義をわかってもらおう、そう考えました。そしてその方々が周囲の人に自己検診の必要性を伝えてもらうしかない、そう思ったのです。
そこで私はブレスト・アウェアネスという言葉を用いて、まずこの講演を聞いてくださるような方、そしておそらくは定期的に検診されておられる方に、もう一度、自己検診は必要なんだ、そして自己検診をする意味はあるんだ、とわかってもらおうと考えました。
伝えきれたか? あまり自信がありません。もう一度書いてみたいと思います。

まず通常はマンモグラフィ検査を受けられると思います。
ここで”異常なし”で安心して終わりではいけないのです。
まず自分の乳腺の状況を知りましょう。
”高濃度乳腺あるいは不均一高濃度乳腺”とされた方
これらの方はマンモグラフィで検査しにくい部位がある、という
ことになります。つまりそれだけで油断してはいけないのです。
超音波検査を追加しておくことが理想ですが難しい。
その場合は自己検診が極めて重要になります。
マンモグラフィで異常なしとされても、自分の乳腺の濃度は高くないか? を知っておく必要があります。これが自分の乳腺の状態を知ろう≒ブレスト・アウェアネスなのです。
マンモグラフィで濃度が高い、あるいは異常が疑われた、
そうした方は乳腺超音波検査を受けられることになります。
ここでも異常なしとされて安心できるのですが、ここでも
自分の乳腺の状態を知ることが必要です。
たとえば嚢胞と呼ばれる分泌液をためた袋、線維腺腫、
福乳などさまざまな良性病変を持っておられる方がおられます。
可能ならその場所を聞いて、その時に自分で触れる、触って
わかるものかどうか、試しておきましょう。
超音波検査で異常なしとされても、自分の乳腺には自己触診の際に邪魔になるものはないか、あるとしたらそれはどこにあるのか、知っておくのです。

異常なし、と診断されました。何よりです。
ただそれでいつまで自分は安心なのでしょうか?
1年、2年、それとも半年?
自己検診はするに越したことはないでしょう。しかし、3か月後
再検査をします、その際には自己検診は必要ないでしょう。
しかし2年に1回の検診を受けようと思います、その際には
自己検診はしておいてください、そういわれるはずです。
たとえば血縁者にたくさんの乳がんの方がおられる、しかも
非常に若くしてなられた方がいる、男性乳癌の方がおられる、
それこそ遺伝性乳がん卵巣がん症候群と診断された方がおられる、
こうした方はもちろんそれ以外の方と同じ検診では危険です。
異常なしとされても、自分はどれくらいのペースで検診を受けていくのが理想なのか?医師に確認しておきましょう。そしてそのペースが自分には難しい場合には、例えば半年おきと言われてもできない、そんな場合には自己検診の仕方も一緒に指導を受けておくべきなのです。
検診に行かれて、あるいは検査を受けられて異常なしとされた、一番安心な今日、今日こそ入浴の際、あるいは就寝前に徹底的に自己検診しておきましょう。
正常と診断された今日が、自己検診における正常な自分の乳腺の状態を把握しておく、最高のチャンスなのです。そしてそれこそが究極のブレスト・アウェアネスなのです。
普段は逆に今日ほど意識しなくても構いません。検診を受けた今日との違いに気を付ければいいだけです。でも今日の状況は時間とともに記憶から消えていきます。だから今日の状況はしっかり覚えておく必要があります。超音波で異常ありとされ、自己触診でも触ることができる、蝕知できる病変は、位置、大きさをしっかりメモしておくことを勧めます。何かの際に気になったら、今日の状況と比較するためです。メモが面倒な場合は携帯電話の録画を使います。声に出してここに1㎝位のしこりを触るけれども、良性と診断された、と残しておくのです。そうすれば大きさも一も変わりなければ無視しても構いません。
逆に検査を受けた日に記録されていないもの、気が付かなかったものはすべて異常と考えるべきです。
このように検診を受けた日に徹底的に自分の乳腺の状況を覚えておくこと、これがブレスト・アウェアネスの理想の形なのです。

月1回、もちろん週に1回でも構いません。
スポンジやタオルをつかわず、乳腺を手で洗うようにしてみて
ください。隅から隅まで意識的に行いましょう。
生理がある方では終了後1週間など、時期をそろえたほうが
理想です。授乳中の方はしっかり授乳した後に触りましょう。
大切なのは、検診を受け、正常と診断された時との”違い”です。
その時になかったもの、それは痛みの有無、動く動かない、
固い柔らかい、大きい小さい、関係なく異常と考えましょう。
正常な時にはなかったのですから。それは異常です。
がんかどうかの診断は触るだけではできません。
1週間程度様子を見ることは問題ないですが、数か月以上待つこと
はとても勧められませんし、危険です。
この繰り返しが理想の検診になります。
読まれればわかると思うのですが、検診を受けられた方にも、いえ方こそ自己検診を勧めています。
何より検診を受けなければもっとも重要な 4.正常な自分の乳腺を把握する過程が抜け落ちてしまいます。正常な状態がわからない方が異常を探すから、いままで自己検診は難しい、わからない、とされてきたのです。
逆に1.から5.まできちんとこなしてきて、また1年、あるいは2年後に1に戻る際、検診を受ける前日に自分でもう一度触ってみて、「よし!絶対に前回検診を受けたときと同じ状態だ、ちがうところはない!」と言い切れるなら、2㎝を超える乳がん、つまり大きさから診断される進行がんはない、と言い切れます。これは私の臨床上の経験した5500例の症例の検討から見つけ出したデータです。
検診に興味を持っておられない方、その方に受けてみようと思わせてくださるきっかけはおそらくこれを読んでおられる方、あるいは講演を聞いておられたような方でしょう。
その方は、検診を受けておられないお友達にこう言っていただきたいのです。
「まあ検診を受けたくないならそれでもいいよ。今でも9人に8人までは一生乳がんにはならない。だから検診はいらない。でも9人の中の一人になった時、診断が遅れたらやっぱり人生が変わってしまう。
だからせめて自分では時々乳腺を触って気を付けようよ、私もそうしているよ。
ただね、自分で検診するにしても1回は検診受けないと何が正常で何が異常かわからないでしょう。1回検診を受けておけば、何か気になった時にどこに行けばいいか、そしていったらどんな検査をされるのかもわかるじゃない。クーポンもあるんだから一度は受けておこうよ。」
2022.07.01
コロナの影響で医学集会や学会の多くが長らくオンラインのみの開催でした。
内容だけならオンラインでも勉強できるかもしれませんが、学会会場に行って実際に参加すると、会場全体の反応も体で感じられます。自分の専門分野以外の発表であっても、会場におられる世界第一線の先生方の反応をみていれば、それがどれくらいの意義のある発表なのか、自然とわかるものです。
今年は米国シカゴ、マクコーミック巨大会場で、かつまた医師が今まで通りに参加できる形で世界最大と言って過言ではないでしょう、がん治療の学会、米国臨床腫瘍学会(ASCO) 2022が開催されました。
乳がん領域ではDESTINY-BREAST 04という名前の臨床研究の成果が発表され、大変な話題になりました。これはHER2 Lowと呼ばれるがん細胞を持つ、再発乳がんに対する新しい知見です。再発乳癌の治療において新しい治療法が見つかりました。会場でスタンディングオベーション(みんなが席を立って拍手をする)を受けた、素晴らしい研究について少し触れてみたいと思います。

この研究は”HER2”蛋白と呼ばれるがん細胞の表面に現れる特殊な蛋白に対する治療法についてのものです。がん細胞はもともとは自身の細胞であり、遺伝子的には皆さんの正常な体細胞と同じものです。ただある特定の遺伝子にエラーが生じることによって、無限に増殖したり、他の臓器に転移できるようになったりする変化を起こします。
そしてそのエラーによっては、細胞表面に特殊な蛋白が過剰に表れて、それが刺激を受けることによってなおさら勢いをつけて増殖する、ということが起こることがあります。HER2蛋白は代表的なその一つです。
これに対して、最初に治療薬として開発されたのがハーセプチン®(トラスツズマブ)でした。
この薬剤は細胞表面に異常に表れたHER2蛋白を標的として妨害し、増殖を抑えることができます。そして正常な細胞は基本このHER2蛋白をあまり出していないので、ハーセプチンの影響を受けにくく、そのため副作用が少ない、という画期的なことが起こりました。分子標的薬剤、今までは毒をもって毒を制す、のような抗がん剤から、ある特定の分子の標的を”狙って”薬剤を開発し、がんを抑えることに成功した最初の”大”成功例と言ってもいいかもしれません。
ハーセプチンの大成功はこれまでの治療法を完全に置き換えてしまいました。副作用が少なく、そして劇的に効くのですから、治療の”第一選択”、標準(当たり前に行われるべき)治療となったのです。
ただその理屈からわかられると思いますが、ハーセプチンは劇的な効果をもたらしますが、それはあくまでHER2蛋白を表面に出し、それを利用しているがん細胞だけです。HER2蛋白を利用しないがん細胞もいるのです。その場合はほぼ何の効果もありません。念のためHER2を持たないがんにもハーセプチンを試してみた研究も多くなされましたが、予想通りの失敗に終わりました。
HER2を持っている、持っていない、という観点からがん細胞を調べてみたとき、本来 白黒だけでいいはずですが、段階的に判断されます。
HER2は 0 1+ 2+ 3+と4段階に評価されます。原則3+がHER2陽性なのですが、2+であった場合、念のため遺伝子レベルまで調査(Fish検査)され、2+(Fish-)、2+(Fish+)に分類されます。このFish+はHER2陽性です。HER2 3+、そしてHER2 2+(Fish+)についてはこれまでにさまざまな薬、投与方法が開発され、今では大変予後も改善し、”薬で治せるがん”も視野に入ってきています。手術せずとも抗がん剤だけで消えてしまう可能性がもはや目の前といった段階です。
この抗がん剤でがんが治せる、ということは実は治る治らない以上に意味があります。
なぜか。薬でがんが治せるようになれば、基本的に早期がん、末期がんという概念がなくなるのです。早期がんとは、手術によって取り切れてしまえる可能性があるがんです。目に見える腫瘍を全て切除しても、目に見えない転移が残っている可能性が高いもの、それが進行がんです。明らかに手術でとり切れないものそれが末期がんです。したがって手術しないのであれば、早期、末期はありません。効く、効かないがあるだけです。その意味からは検診を受けておらず、ほぼ末期発見されたとしても、そこから問題なく治せるのであれば検診すら要らなくなります。それだけ概念から変わってしまうのです。
ただいまはすべてのHER2陽性乳がんが薬で消えるのではなく、またHER2陽性乳がんは全体の2割程度しかおられません。早期発見と、そのための検診の重要性は変わりません。

さて、そこまですごいHER2蛋白と、それに対する分子標的薬剤なのですが、HER2蛋白は乳がんにおいて、だいたい15-20%前後しか陽性ではありません。そしてHER2 0+もまた20%強なのです。
だいたい乳がん患者さんの50%強が、陽性でもないが、陰性でもない、HER2 1+、HER2 2+(Fish-)に分類されます。
この方たちがHER2 Lowとされた方たちです。完全な陰性ではないが、いままでのHER2に対する分子標的薬剤によるHER2を標的とする治療では効果が認められなかった、つまり”ほぼ”陰性の方たち。
今回 DESTINY-BREAST 04はこの方たちHER2 Low症例の”再発”乳癌治療にスポットを当てました。
使われた薬剤はTrastuzumab deruxtecan (T-DXd) エンハーツ®と呼ばれる薬剤です。
HER2蛋白にくっつく部分と、トポイソメラーゼ1阻害剤という抗がん剤を、化学的に結合させた薬剤です。これによって細胞表面にHER2蛋白を出しているがん細胞に選択的に抗がん剤を”届けて”やることができます。
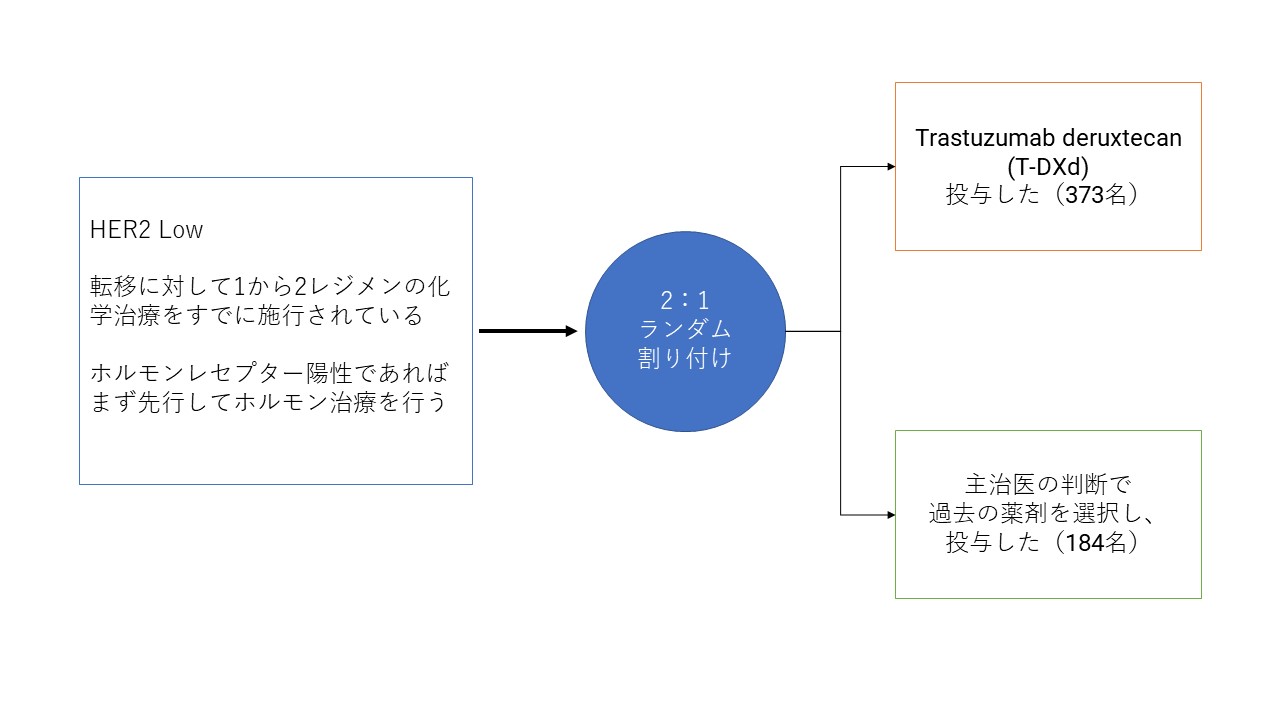
HER2Lowであり、乳癌が再発され、ホルモン剤が効く方はそれをすでに行い、そしてホルモン剤が効かない方であってもすでに1-2パターンの抗がん剤投与がなされて効果が期待できなくなっている方を対象として、ランダム化し、一方の群ではT-Dxdを投与、もう片方では主治医の治療方針に任せる、という臨床試験が行われました。下の図を参照してください。
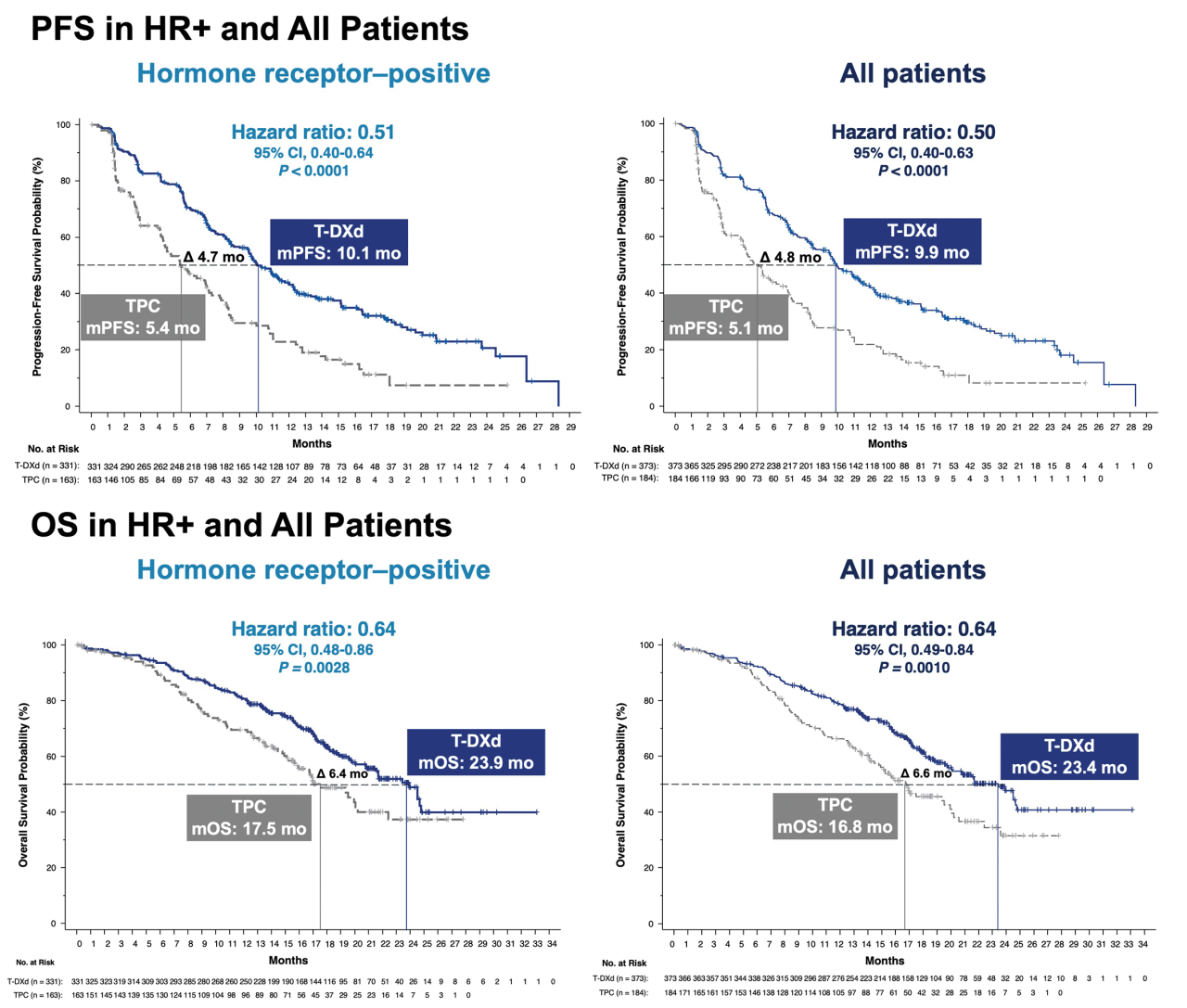
結果は上の図で示されました。
全体の患者さんで、がんが再び増悪するまでの期間をほぼ倍(5.1から9.9カ月へ)に延長しました。
ホルモンレセプター陽性の患者さんでも5.4から10.1カ月に延長しました。
すでに様々な治療を試みられている患者さんをターゲットとしていて、このデータは画期的なものです。ハザード比と呼ばれるものがあります。患者さんによくないことが起こる確率と考えてくださればいいのですが、通常新しい治療法が開発された際に、今までの標準治療と比較して0.7、つまり3割悪いことを減らせれば素晴らしい成果とされるのですが、これがホルモンレセプター陽性の方で0.51、全体で0.50でした。つまり悪いこと、この場合再発したがんの進行が半分まで抑えられたということになります。
会場でのどよめきが目に浮かぶようです。私もその場に居合わせていたら拍手したでしょう。
新しい考え方、新しい治療の誕生の瞬間です。HER2 Lowは、決して=陰性ではなかったのです。
これだけ劇的に効けば、HER2Lowの方が再発した際には第一選択、つまり標準治療になる可能性があります。そして今までの分子標的薬剤の素晴らしい成果を考えたとき、もしかすると再発した乳がんも治せる可能性があるかもしれない、誰しも期待するのではないでしょうか。
副作用も比較されていますが、対象群が主治医選択薬剤なのでバラバラになっており、あまり参考になりません。ただ結局は対象群も抗がん剤を投与されているため、比較すればそれほど強い副作用もありませんでした。発表からは、T-DXdは嘔気が強い薬剤なのだな、という印象を持ちました。
*******************************************
おそらくこれを受けて間違いなく、HER2 Lowの患者さんへの考え方は変わります。
今回の発表の意味は決してT-DXdの新しい使い方が分かったことだけにとどまりません。
「HER2 Lowは=陰性ではないのだ」ということが証明されたことが大きいのです。HER2がわずかでも表れていたら治療法の選択肢として、抗HER2薬剤を検討するべきだ、ということが分かったのです。このことがなんといっても画期的なのです。HER2 Lowとされていた患者さんのがん細胞は、実はHER2の経路を使って増殖していた、ということが証明されたとも言えます。
HER2への治療はすでに乳がん以外にも広く広がっています。乳がん以外のがんは乳がんほど強くHER2を表出しないことが多い。ということは・・・などなど。
今後の発展次第によっては多くの患者さんに福音となる可能性があります。楽しみです。
Dr. Shanu Modi: DESTINY-Breast04 Establishes Trastuzumab Deruxtecan As a New Standard of Care for HER2-Low Metastatic Breast Cancer. 2022 ASCO ANNUAL MEETING, June 6, 2022. https://dailynews.ascopubs.org/do/10.1200/ADN.22.201047/full/?cid=DM10847&bid=180009772
2022.06.14
近年 乳がんの原因となることで有名なBRCA遺伝子を検査することが保険収載されました。
女優のアンジェリーナ・ジョリーさんがこの遺伝子が陽性であり、乳がんの障害リスクが高いことから、”予防的”な乳房切除を行ったことを公表され、有名になった遺伝子です。このことはこのブログでも何度も触れてきました。よかったら読んでください。
と言ってもそのリスクがある方が対象で、希望者すべてに検査をすることは認められていません。
もちろん自費診療で検査をすることは可能ですが、数十万円する大変高価な検査なので、そうそうできません。採血だけなので、受けてみたい方も多いかもしれませんが、医師に相談してまずリスクの高い方が受けられて、陽性と診断された場合に、その血縁者が受けられる方が無難でしょう。もしその場合に血縁者が検査をされるのであれば自費であっても数万円程度で検査できます。それでも高価ですけれども。
乳がんとの因果関係が強いために”乳がんの遺伝子”というように表現されることも多いこのBRCA遺伝子ですが、そうなると男性は関係ないようなイメージです。ところがBRCAは決して乳がんだけの遺伝子ではなく、”がん”の遺伝子なのです。つまり男性にも関係します。
今年 米国臨床腫瘍学会ASCOでこのことに関する大きな研究発表がありました。
フリーアクセスですが、英文論文なので厳しいと思います。可能であれば原文を参照いただくのがベストですが、ここではそれを要約して紹介したいと思います。
文献:Cancer Risks Associated With BRCA1 and BRCA2 Pathogenic Variants
S. Li, V. Silvestri, G. Leslie, T. R. Rebbeck, S. L. Neuhausen, J. L. Hopper, et al.
J Clin Oncol 2022 Vol. 40 Issue 14 Pages 1529-1541

BRCA遺伝子には大きく、BRCA1とBRCA2があります。
それぞれについて男性のがん、女性のがんについて、どの部位のがんに関与しているのか、研究がなされました。また発症リスクについても発表されました。
この発症リスクですが、簡単に説明します。
たとえば BRCA1遺伝子に変異がある方は乳がんに罹患するリスクが変異のない方よりも高い傾向があります。そしてそれは40歳代では+○○%、50歳代になればさらに上昇して+●●%というように多くの場合年齢を重ねるほどリスクは上昇するのです。それもまた調査され、発表されています。
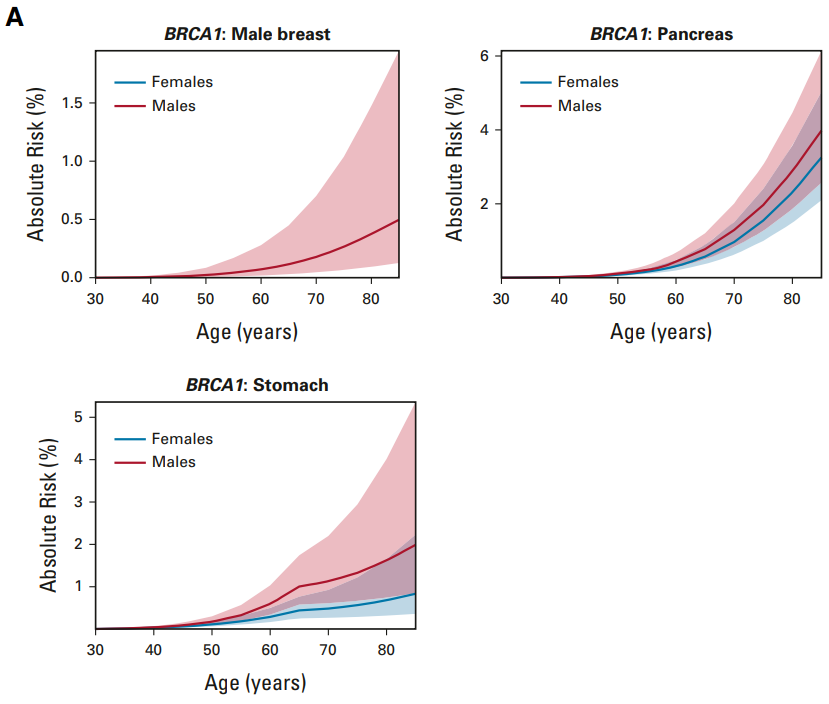
上の図ですが、BRCA1陽性の方について の検討です。
左上、”男性乳がん Male breast”の発症リスクです。幅がありますが、70歳頃で0.1から0.2%でしょうか。1000人おられたら1から2人ということでしょう。男性とはいえ乳がんなので、これは予想できることかもしれません。思ったよりというと不謹慎ですが、50%を超えてしまう女性に比較すればリスクは高くないですね。
右上 スケールが違うので注意してほしいところですが、実は”膵がん Pancreas”のリスクが上昇しています。男性女性とも70歳頃には1%に達しています。これは怖いですね。検診の必要性を感じます。
さらに左下 ”胃がん Stomach”です。これも膵がん同様に男女差があって、より男性の方が罹患率が高いようです。70歳代で男性1%、女性0.5%前後のようです。
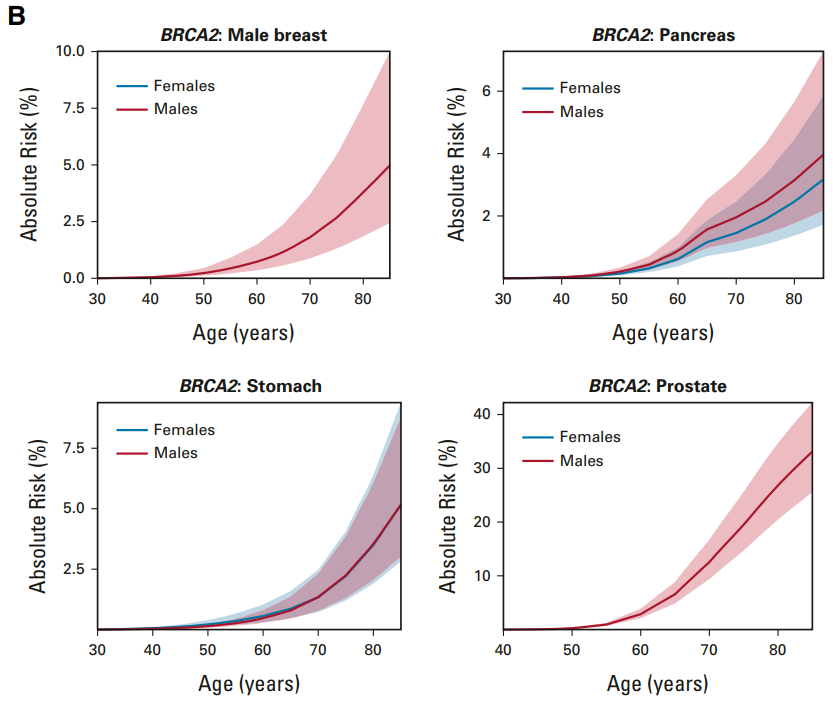
次に BRCA2陽性の方のリスクです。
左上、男性乳がんのリスクですが、BRCA1よりも高いようです。70歳で2%前後ありそうです。
右上 すい臓がん これは男女とも70歳で1.5%前後あります。
左下 胃がん これは男女差なく、70歳で2%前後でしょう。
右下 前立腺がん 前立腺は男性にしか存在しない臓器です。これは70歳で10%前後になっています。
男性乳がんでは最も高い頻度で、関与が示唆されていますね。

「私 息子しかいないので、遺伝を調べても・・・」と言われる乳がん患者さんもおられますが、これを見ると息子さんがおられたら調べておく意味はあるように思います。
「私同様、娘もきちんと乳がん検診しているので心配していません」といわれる患者さんもおられますが、すい臓がん、息子さんも前立腺がんの検診をしていないのでは心配です。
このように遺伝の変異について、知っておくことで対応が変わります。なにより、その人に応じた、その人のリスクに応じた検診や検査をしておくことで対応できる、と考えてほしいと思います。
そのためにはまず保険で検査ができる、乳がん患者さんご自身がまず検査を受けておくこと、が重要になります。その後は大切なご兄弟、親御さん、娘さんや息子さん、甥御さんや姪御さんにすこしずつでも話をして、検査を受ける、受けないまでも注意する、知識を持ち増やしていく、そういうご指導されることも大切かと思います。ご検討いただければ幸いです。
2022.04.24
今年もASCO(米国臨床腫瘍学会)が開催されます。
がん治療の歴史を変える、歴史を作る学会なので、がん治療にかかわっている医師は要注目です。ただ残念ながら英語なのでどうしても情報が遅れます。
いつも思うのですが、誰かの翻訳に頼っていれば、その誰かの影響を排除することはできない、ということです。どこかの企業のサイトを見れば、ASCOに限らず最新の海外の学会のトピックスが翻訳されて乗っているかもしれませんが、それはその企業にとって都合にいい記事であって、都合の悪い記事は乗っておらず、したがって情報を欲しがる患者さんにとって、本当に欲しい情報ではない、ということです。もちろんその意味において私のこのサイトも同様です。まして翻訳されていればなおさらです。皆さん自身で情報を取捨選択することは常に求められます。
こういう記事を見たら、Google翻訳などを使ってご自身でも目を通しておくことを勧めます。日本語は少しおかしいですが、そういったバイアスの侵入を防げます。
今年のASCO Daily NEWS(https://dailynews.ascopubs.org/do/10.1200/ADN.22.200900/full/?fbclid=IwAR0qt1bfiU8JHrvlPuC6SJf6Gja_Dqpu2nyYL45--eul1IxBX9YSGrzUeQ8)の記事に、がん患者さんの食事指導についての記事が出ました。
今まで医師は患者さんの「食事にはどのように気を付けたらいいですか?」の質問にきちんと答えられていなかった、という題目です。面白いですね。
ただこの記事はたとえばがんにならないために、とか、がんを治すために、という食事ではありません。がんの治療を受けられている方、とくに抗がん剤治療中の方に意味のある記事です。
もともと食事の変更だけではがんは治らない、と考えてください。
英語の記事は最初にまず結論を提示してくれることが多いので、ここでもそれに倣います。

この3つです。期待外れでしたか?
記事にはもうすこし具体的な抗アレルギーダイエットについて説明があります。表2とされている部分です。
| 食事には気を付けるようにしましょう(注意深い食事を実践しましょう) |
|---|
| 一人で食事をせず、誰かと一緒に食事をしましょう |
| 1日にからのコップで5から8杯ほどの水を飲みましょう |
| いわゆるソフトドリンク(ジュースや炭酸飲料など)は、たとえダイエット飲料であっても避けましょう |
| 毎日 朝食を摂りましょう |
できるだけたくさんの野菜や果物を摂りましょう。できるだけいろいろな色の野菜や果物を摂るように心がけるのがお勧めです |
| 穀物は全粒粉がお勧めです |
| 果物やナッツなどの健康的な間食を摂りましょう |
| 動物性の脂肪やタンパク質は制限してください |
| トランス脂肪を避けましょう |
| いろいろなスパイスを使ってみてください(筆者注:化学治療中は好みや苦手が変化するので) |
| 適量の摂取を心がけましょう |
この文章の最後にもう一度この記事の重要なポイントが示されています。
新しく診断された患者さん、治療中の患者さん、がん治療を終え、サバイバーとなった患者さんの全てに言えることであるが、食事指導を行う際に最も重要なことは、あまりに厳格な食事制限を避けることである。
この記事の関連記事で、アルコールはできるだけ避けましょう、という項目があったことを追加しておきます。
時々ネットや週刊誌などで 食事でがんを治す、ような記事を見かけます。ここを訪れた方もそれを期待していたかもしれません。ただ根本的な視点に立てば、どのような食事であってもがんを治すことはできないことがわかります。この記事でもたとえば抗がん剤で食欲が落ちたり、好みが変わっていままでの食事が受け付けなくなった時の乗り切り方に焦点が置かれています。
その”根本的な視点”ですが、がん細胞は決して体の外から来たものではなく、自分の細胞そのものである、ということです。たとえば子供さんが3人おられるお母さんを想像してください。そのうち一人の息子が悪い、他の子をいじめます。お菓子もご飯も取り上げて食べてしまう。おかげで他の二人は栄養失調です。お母さんはその子だけを懲らしめてやりたい。そこでお母さんはその子だけが下痢してしまう献立を考えることにしました。さてどんな献立を考えればその子だけ下痢で凝りるような食事を作れるでしょうか?
難しいですよね。その子が勝手に食べすぎて下痢して懲りるのを待つくらいしかできません。
ましてがん細胞も、自分の正常な細胞ももともとは一つの受精卵、つまり先ほどのたとえの子供たちは三つ子です。年も背格好もほぼ同じ。なおさら難しい。食事の内容で懲らしめるのはほぼ不可能ですね。よく食べることを利用して、食べ過ぎたら下痢をする、そんな献立を考える。そうだとしても正常な細胞が万が一食べ過ぎたらやはり下痢してしまいます。つまり副作用です。
そもそも食べ物だけでがんを根絶すること自体ほぼ無理な相談なのです。
ですのであまり厳格な制限にこだわるのではなく、バランスよく栄養をとる、適量の栄養を摂取することを中心に考えましょう、と書かれているのです。
最近 Lanset Oncologyという雑誌に、このブログの第4回の趣旨とほぼ同じ内容の論文が発表されました。つまりタモキシフェン VS アロマターゼ阻害剤というテーマです。
私がブログで論じた内容と異なり、この論文がユニークなのは、この論文は”閉経前”患者さんについて書かれたものであることです。本来 閉経前患者さんにそのままアロマターゼ阻害剤を用いても効果はありません。ですので閉経前の患者さんであれば手術や薬剤など、何らかの方法で卵巣機能を抑制し、閉経状態としてから用います。
メタアナリシスという、こうした議論をするには最も信頼できるデータを提示できる方法で検討されていますので、ここでもう一度触れてみたいと思います。
英語版でよければここから読めます。
Aromatase inhibitors versus tamoxifen in premenopausal women with oestrogen receptor-positive early-stage breast cancer treated with ovarian suppression: a patient-level meta-analysis of 7030 women from four randomised trials
www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00758-0/fulltext
ちなみにメタアナリシスというのは、前向きランダマイズ(二重盲検)という、単独でも十分に信頼性の高い方法で検証された論文を、さらに同様のテーマのものを数個以上集めてさらに検討するという方法です。たとえば過去に標準治療とされてきた治療法を、新しい治療法、薬剤に置き換えてしまう場合に行われる検証法で、臨床における研究方法ではこれ以上信頼できる方法が今のところありません。
そこでメタアナリシスで結論が出れば、以降はそれが世界的に標準治療になります。
それが2022年2月3日付の論文で出てくるのですから、このタモキシフェン VS アロマターゼ阻害剤というテーマは、私がブログを書いた時点ではやはり結論が出ていなかった、と言ってもいいのでしょう。
それでは今回の論文ではこの比較検討に結論が出たのでしょうか。
ここで第4回の復習をしておきましょう。
・アロマターゼ阻害剤はタモキシフェンと比較して、ハザード比で0.8前後をもって乳がんの再発を抑制する。
・アロマターゼ阻害剤ではタモキシフェンと比較して、骨折の頻度を含めて、骨粗鬆に関する副作用が頻発する。
・タモキシフェンは、アロマターゼ阻害剤と異なり、子宮体がんの確率が増える副作用を持つとされるが、統計的にみると、乳がん以外のがん死は、タモキシフェンとアロマターゼ阻害剤で差が認められない。
ただしこれは閉経後患者さんに関する検討をもとに述べたものでした。

今回の論文ではABCSG XII、SOFT、TEXT、HOBOE試験という4つの論文からデータを集めました。ホルモン剤に対する感受性を有する乳がん患者さんをなんと合計で7,030例、平均8.0年追跡して得られたものです。
結論ですが、アロマターゼ阻害剤はタモキシフェンと比較して、ハザード比で0.79で乳がんの再発を抑制していました(RR:0.79、95%信頼区間 0.69~0.90、p=0.0005)。これは第4回の結論と同じです。乳がんの再発抑制効果については、閉経前の患者さんであっても、アロマターゼ阻害剤はタモキシフェンよりも優れていることが確認された、としていいでしょう
これはもはや揺らがない事実としていいでしょう。ほかの要素を加味せず、乳がんの再発抑制だけを考えるなら、あるいは最優先とするなら、アロマターゼ阻害剤は第一選択です。ただしここで繰り返しますが、アロマターゼ阻害剤”単独”では閉経前の患者さんに効果はありません。卵巣を薬剤で抑制しておく、手術で切除されている、ことが前提として必要になります。この試験もその条件で行われています。
タモキシフェンをアロマターゼ阻害剤とする再発抑制効果の違いは、治療開始から4年間に認められており、5年再発リスクの絶対値で3.2%低下していました(5年間で再発するリスクとしてアロマターゼ阻害薬 6.9% 、タモキシフェン 10.1%)。
しかしそれ以降 5-9年、そして10年以降では、タモキシフェンをアロマターゼ阻害剤とするメリットは認められませんでした。
・乳がんによる死亡、再発を伴わない死亡、全死因死亡に関しては治療間の有意差は認められませんでした。これに関しても第4回に触れたことと同じです。
ただ 全死因の死亡では乳がん以外のすべての亡くなった患者さんをカウントしていますのでまだわかるのですが、乳がんの再発を確実に抑制するのに、乳がんによる死亡では差が出ないのはなぜなのでしょうか。そこはどうしても納得のいかないところです。また機会を改めてその点を解説してみたいと考えていますが、少なくとも再発を抑制する効果が、すぐさま生死にかかわるレベルにまで影響するほど大きくない、ことは言えるのではないでしょうか。
そして気になる骨粗鬆に関する副作用ですが、これもアロマターゼ阻害薬は、タモキシフェンよりも骨折が多かったことが明らかになりました。ハザード比 1.27ですので、第4回に合わせるなら、タモキシフェンはハザード0.73で骨折を抑制します(本当はこんな逆算みたいなことをしてはいけません。参考としてみてください)。これもまた第4回に書いたことと同じです。
結局 第4回で書いたこと、大きな3つの要点は閉経前の患者さんでも言えました。
ただ閉経前患者さんは若い方が当然多い。なので少しでも再発を抑制できるアロマターゼ阻害剤を選択したい気持ちは強いでしょう。ましてStage II、III、あるいはリンパ節転移があった、など進行がんとされた方ではなおさらなのではないでしょうか。

これは大変不思議なこと、これは論文の中で筆者の先生も書かれていることなのですが、
リンパ節転移が多かった方、0個よりも1-3個、4個以上の方と多ければ多いほど、転移の傾向を表し、よりがんが進んでいることを表しているとされます。したがってアロマターゼ阻害剤の転移抑制効果はより強く出るのではないか、誰もがそう期待します。ところが下の図を見てください。
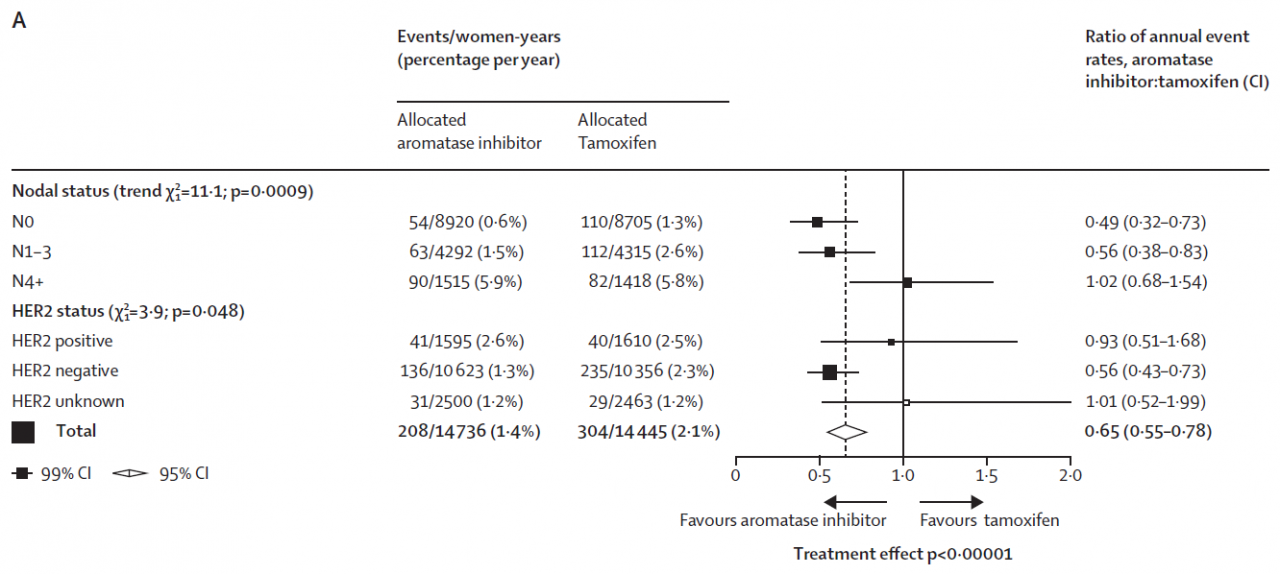
図 右下の方に左右に開く矢印があります。(このような図をForest (Tree)Plotと言います)
Favours aromatase inhibitor(アロマターゼ阻害剤のほうが優れている)
Favours tamoxifen(タモキシフェンのほうが優れている)という矢印です。
図左上 N0はリンパ節転移無し N1-3は1個から3個の転移、N4+はそれ以上の数のリンパ節に転移があったということです。そして下に行けば行くほど、図では■と横線が右へ、つまり「タモキシフェンのほうが優れている」に移動しているのです。
この現象は少なくとも、閉経後の患者さんに対する検討では認められませんでした。さすがに筆者も理由を推理できなかったようです。少なくとも自分は進行がんだったから、タモキシフェンよりもアロマターゼ阻害剤だ、と単純には決められないことが示されてしまいました。
筆者の先生も、これは今回の検討でもっとも予想外だった結果になる、と書かれていました。
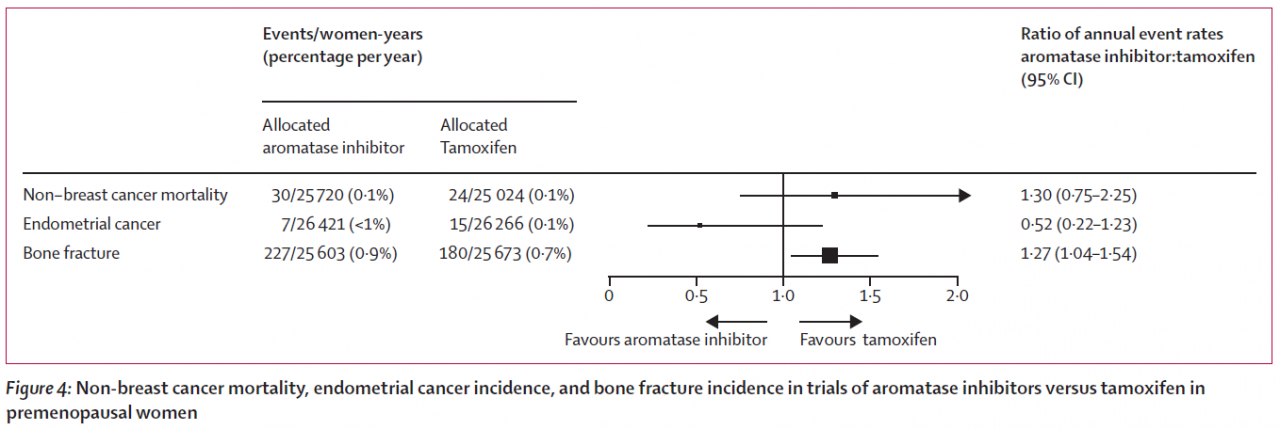
Forest Plot に触れましたので もう一つの図を紹介させてください。
実は中心の1.0の垂直線を、横線がまたいでいる場合と、またいでおらず、完全に片方によってしまっている場合では、後者の方が ”信頼できる結論”とされています。
上から、乳がん以外のがんによる死亡、ですが、"タモキシフェンのほうが優れている”に振れていますがまたいでいます。
2番目、子宮体がん(Endometrial cancer)、これは左、つまりアロマターゼ阻害剤が優れる、に振れていますが、またいでいます
Bone fracture、骨折ですが、これはタモキシフェンが優れる、に完全に振れています。
タモキシフェンを飲まれる方は、子宮体がんの検診は受けておくべきだけれども、それで亡くなってしまうようなことは、必要以上に恐れなくてもよい、とは言っていいのではないでしょうか。
ここまでの結論
閉経前の患者さんであっても、LH-RHアゴニスト(ゾラデックスやリュープリン)を使用すれば、閉経後と同じ状況になるので、アロマターゼ阻害剤(アリミデックス アロマシン フェマーラ)が使えます。
タモキシフェン VS アロマターゼ阻害剤では、少なくとも再発抑制効果において、アロマターゼ阻害剤の完全勝利です。大体100点と80点の差があります。
それならばすべての患者さんがアロマターゼ阻害剤(閉経前であればそれ+LH-RH)でいいはずです。それならばタモキシフェンはもう消えているはずです。
アロマターゼ阻害剤 Vs タモキシフェン は決着がついたとは言えないように思っています。それでもやはり進行したがんであればアロマターゼ阻害剤を選択するように治療方針を立てますし、骨折によって極端にADL(日常生活や活動)が損なわれてしまう年齢の方で、早期乳がんであればタモキシフェンよりに考えます。
アロマターゼ阻害剤を選択していたとしても、5年以上再発なく経過され、骨粗鬆に由来する訴え、膝の痛みや、手指のこわばりが不快な方では、定期的な婦人科受診を前提として、タモキシフェンへの切り替えを提案していくと思います。
主治医が、その患者さんと話し合いながら、その状況に応じて選択していくべきであって、盲目的に、単純反射的にアロマターゼ阻害剤を第一選択することは、正しいとは言えないと思います。
乳がん術後の再発抑制効果はアロマターゼ阻害剤がタモキシフェンなどのSERM薬剤よりも強い。そのことは紛れもない事実です。
先に触れたとおり、代表的なアロマターゼ阻害剤はハザード比にして0.8前後の再発抑制効果を持ちます。ハザード比 0.8というのはどういうことか。
タモキシフェンががんの再発を抑制しないというのではないのです。
乳がん学会のガイドラインでも「タモキシフェンは,浸潤性乳癌の術後,転移・再発乳癌に対してのみならず,非浸潤乳癌の術後,乳癌発症高リスク例の乳癌発症予防にも有効性が示されている」とあります。
ホルモン剤を使用しない、ことと比較してタモキシフェンの無病生存期間(DFS)に与える影響は HR 0.64です。つまりタモキシフェンは、その使用によってホルモン剤を使用しない人と比較してハザード比にして0.64前後の再発抑制効果を持ちます
何も治療しなければ100人再発するとすればタモキシフェン使用(0.64)でそれが64人にまで減ります。
再発が64人起こることが予想される患者さん群に対して、そのホルモン剤をタモキシフェンではなく、アロマターゼ阻害剤(HR0.82で計算します)を用いることにより、52人に減らすことができる、ということです。AIは、タモキシフェンよりも12人とより多く救うことができる。これは文句なく素晴らしいことです。それは否定しようもありません。
ただここでもう一つ考えてほしいことがあります。
乳がんの患者さんには早期発見された患者さんもおられれば、進行して発見された患者さんもおられます。もちろん再発は、早期だろうが、進行していようが防げるものなら防がないといけないし、何としても避けなければいけない。しかしその確率に差があるのは事実です。ホルモン剤が効果がある方は、原則として効果のない方、トリプルネガティブタイプやHER2エンリッチタイプの方より、予後は良好です。
現状ステージ I の早期乳がんの方で再発せずに5年間無事経過される方は98%です。つまりステージ1の早期がんの患者さんであれば、5年後に100人に2名の患者さんが再発されます。
ハザード比が0.82では、タモキシフェンをアロマターゼ阻害剤に変更しても、アロマターゼ阻害剤をタモキシフェンに変更しても、現状では影響を受けるのは1名もおられない、という計算になります。早期がんであればタモキシフェンであっても再発される方はもともと少ないので、タモキシフェンをAIに変更しても恩恵を受けられる方はそれほど多くないのです。

命がかかっていることで、多いも少ないもないだろう。
それはそうです。ただお薬ですから副作用も考える必要があります。
たしかに性ホルモンですから、インシュリンのように0になっても生命に直接は関与しません。ただ女性ホルモンが減少し、更年期で苦しんでおられる方が多いことでもわかるように、ただただ0を目指せばいいものでもありません。
ここで思い出してもらいたいことがあります。
アロマターゼ阻害剤は、女性ホルモンの働きをすべてブロックするのに対し、タモキシフェンは”骨”と”子宮”に対しては、むしろ刺激する方に働きます。

これは第2回の復習になりますが、アロマターゼ阻害剤は女性ホルモンというカギそのものをすべて抑え込んでしまいます。タモキシフェンは偽カギです。乳腺の鍵穴に刺さって、塞いでしまうので、女性ホルモンが働かなくなります。ただ骨と子宮の鍵穴には刺さって”回せる”ので、刺激してしまうのです。
骨に対してはこれはしかしいい効果になります。
アロマターゼの副作用で、骨粗鬆はよく知られています。しかしタモキシフェンはむしろ逆に骨粗鬆を防ぐ働きをします。
ただ子宮に対しても刺激することは、いいことばかりではありません。本来閉経して痩せていくはずの子宮内膜が、刺激されて厚くなってしまうので、子宮体がんの検診が難しくなります。さらにわずかですが子宮体がんの率が上昇することが知られています。
先ほどハザード比という話をしました。骨粗鬆の最悪のイベントは骨折です。
ご高齢の女性にとって、骨折する場所によっては長期臥床につながる恐れもあります。AIは閉経後女性が対象ですから、高齢の方が多く、問題になることも多くなります。
これに関してはアリミデックスについて行われたATAC試験で詳細な結果が示されています。
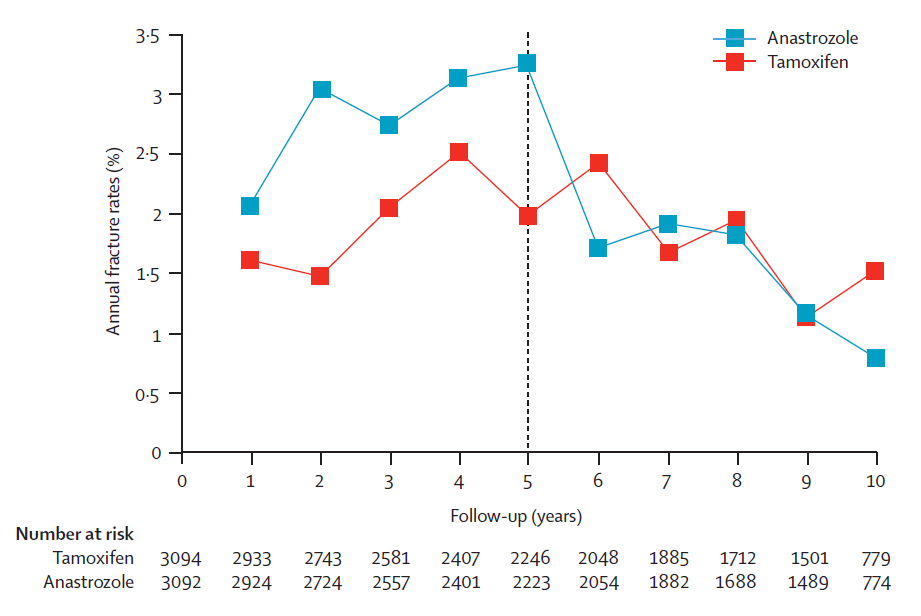
5年後にホルモン剤を中止すれば、両群で差はなくなっていきますが、飲用が継続されている5年間では常にアリミデックス(アロマターゼ阻害剤)を飲んでおられる方の骨折の発生率が、タモキシフェンを飲んでいる方を上回っています。平均すれば年に3%前後、と2%前後の差がある、と言い切っても賛成していただけるでしょう。もしハザードにすればこれはタモキシフェンを飲むことで、アロマターゼ阻害剤によって引き起こされる骨折とハザード比で0.66の差がある、と言い直せると思います。
つまり、アロマターゼ阻害剤はタモキシフェンよりもハザード比0.8で再発を抑制するが、タモキシフェンはアロマターゼ阻害剤よりもハザード比0.66で骨折を抑制する、と言えてしまうのです。
「おいおい、再発と骨折を一緒にするのか?再発は命に直結するけれど、骨折しても直せばいいじゃないか」そういう声もあるでしょう。
ただ、ご高齢の方にとって、もし長期臥床、そして寝たきりになってしまわれれば、長生きできてもうれしくない、と言われる方もおられるかもしれません。また骨折にまで至らなくても、膝痛、腰痛など、動作時に痛みが継続すれば日常生活がつらいものになります。あるかどうかわからない再発よりも、この関節痛を何とかしてくれ、そう言われる方もご高齢になればなるほど増えていくことは理解できます。
その意味から、少なくともご高齢、かつ早期乳がんの方に関していえば、一律 アロマターゼ阻害剤が一択だ、とは言えなくなります。
子宮体がんについてはどうなんだ、増えるのだろう?
そういう声もあるでしょう。再発の抑制効果に劣り、子宮体がんの確率がわずかながら上昇する。
どちらも命に係わるものなので、深刻に見えます。ただそれならばタモキシフェンを飲まれておられた方は、アロマターゼ阻害剤を飲まれていた方よりも、なんだかんだで長生きできていない、という結果になることが予想されます。
これもATAC試験に答えが示されています。
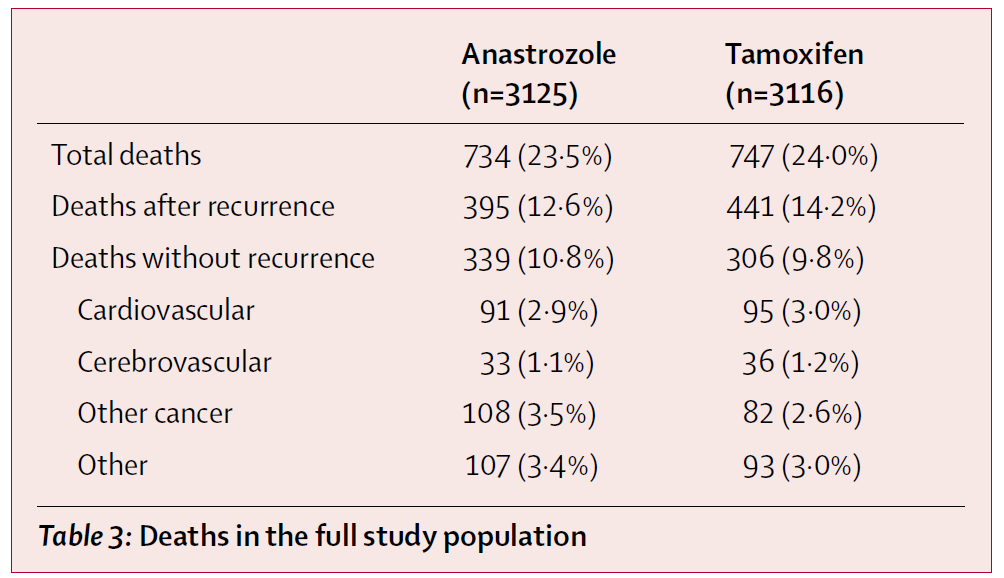
このデータはこのアリミデックスとタモキシフェンを比較するこの試験において、亡くなられた方をすべて調査したものです。つまり再発して乳がんで亡くなった方、それ以外の原因で亡くなられた方すべて調査したものです。
全体ではアリミデックスの群では23.5%、タモキシフェンでは24.0%の方が亡くなりました。
再発して亡くなった方はそれぞれ 12.6%、14.2%ですので、やはりアリミデックスが優れています。
しかしそれ以外で亡くなった方を見ると、それぞれ10.8%、9.8%でタモキシフェンが優れています。
その原因も調査されていますが、”Other cancer” つまり 乳がん以外のがんで亡くなられた方はそれぞれ3.5%と2.6%ですので、タモキシフェンのほうが多いとは言えませんでした。
全体の生死で見たときにはタモキシフェンが圧倒的に劣る、とはやはり言い切れないのです。
このデータは5年間の投与で示されたものです。しかし現在ホルモン治療は、期間が延びており、10年間、あるいはそれ以上、飲まれる方も少なくありません。そうなればより微妙なバランス調整が必要になることが予想されます。60歳の方と70歳の方、80歳の方では人生について、余命についての考え方と、日常生活における”痛み”に対する考え方は異なって当たり前だからです。
「先生、膝が痛くって痛くって…整形外科に言ったら骨粗鬆と言われて薬が出ました。痛み止めも出してもらっています。」
「いやでも、ちょっとでも再発しないほうがいいに決まっていますからね。」
これを60歳の方にも、70歳の人にも、80歳の人にも全く同じように説明していたら、やはり木を見て森を見ず、病を見て人を見ず、ではないでしょうか。メリットデメリットを説明して選択するのは、患者さんの意見も聞いてからのことと考えます。

こうしたことが示していることは、すべての患者さんに、共通して同じように同じ治療が最善とは限らないということです。当たり前といえば当たり前で、そのためにわれわれ”主治医”が存在しています。
患者さんには、だれだれさんはアロマターゼ阻害剤を飲んでいるのに、なぜ私はタモキシフェンなのですか?という疑問を持たれる方がいます。ここではそれに対して答えになる一つの根拠を示しました。
抗がん剤はほぼすべての乳がん患者さんに再発抑制効果があります。抑制効果が0、ということはまずありません。ではすべての方に抗がん剤を勧めるか、答えはNoです。効果だけから判断するものではないからです。すべての治療、薬にはメリットデメリットのバランスがあります。そしてそこにAIではなく人間が主治医である意義があると思っています。
疑問を持ってはいけないのではありません。そこに主治医がその患者さんを診て、選択した理由と、医師としての意思が存在していることを知っておいてほしいのです。
尋ねてみてください。きっと答えてくださると思います。
参考文献
1. Cuzick J, Sestak I, Baum M, Buzdar A, Howell A, Dowsett M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial. Lancet Oncol. 2010;11(12):1135-41.
2. Early Breast Cancer Trialists' Collaborative G. Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet. 2015;386(10001):1341-52.
3. Regan MM, Neven P, Giobbie-Hurder A, Goldhirsch A, Ejlertsen B, Mauriac L, et al. Assessment of letrozole and tamoxifen alone and in sequence for postmenopausal women with steroid hormone receptor-positive breast cancer: the BIG 1-98 randomised clinical trial at 8.1 years median follow-up. Lancet Oncol. 2011;12(12):1101-8.
私がたびたび引用している米国臨床腫瘍学会(以下 ASCO)ですが、今年の学会が終了してほぼ2か月経過した今の時期、その学会で発表された大きなデータをもとに、彼らが推奨する標準治療の刷新を発表します。
標準治療とは、日本の”標準”という意味合いと少し異なっていて、”王道”というほうが近いかもしれません。がんの治療は命がかかっていますので、松竹梅で決められてはかないません。最善は一つ、よって王道も一つ、それが標準治療です。(ただし現状、どちらが優れているか決められない時は2-3つの選択肢が提示されていることもあります)
ASCOが標準治療として定めるガイドラインが改定される、その際にはかれらはその新しい項目をピックアップして発表します。変更のないところはあえてもう一度発表しなおす必要はありません。なのでその発表を読めば、今年どんな新しい治療が開発されたのか、そしてその治療はいままでの王道とされてきた治療を塗り替えるものだったのか、あるいは今までにない新しいバイオマーカー(指標となる検査結果、それによって最善の治療方法が変化する)が出てきているのか、一気にまとめて知ることができるのです。(なんて便利なのでしょう。)
先日も”FACEBOOK”にてASCOから発表がありました。
ちなみに乳がんだけではありません。様々な臓器のがん、大腸がんや膵がん、様々に進行したがん、早期がんや、進行がん、転移性のがんなど、それぞれについて今年の最新のデータを基にしたガイドラインの改定が、別々にまとめられ発表されていきます。さまざまな先生方が集まって、今年の新しい発表に他の学会の発表や論文も加えて、話し合いを重ね、できるだけシンプルに整理して発表されていく、そんな感じです。(ああ、本当になんて便利なのでしょう。)

2CDK4/6阻害剤は、閉経後女性に対してはノンステロイダルなアロマターゼ阻害剤(筆者注:日本ではアリミデックス®、フェマーラ®がそれに相当する)との併用を勧め、閉経前女性に対しては何らかの卵巣機能抑制(外科的に卵巣を摘出することを除けば、ゾラデックス®や、リュープリン®などのLH-RH製剤を使用する)を行った上で、それらを行うことを推奨する。
これらが示されました。難しいですね。
この記事に興味を持つ方以外だと、理解は難しいと思います。ただすでにホルモン剤とCDK4/6阻害剤を飲んでおられる方で、さらに効果が弱くなって来られている状態の方だと、不安な日々を送られているでしょうから、こうした記事は理解もでき、興味もあるのではないでしょうか。
つまり先述した状態の方であれば、こう読んでほしいのです。
PIK3CA遺伝子の変異を調べ、その異常が見つかれば、アルペリシブという新薬が効果を示す
これが今年新しく示されたのです。
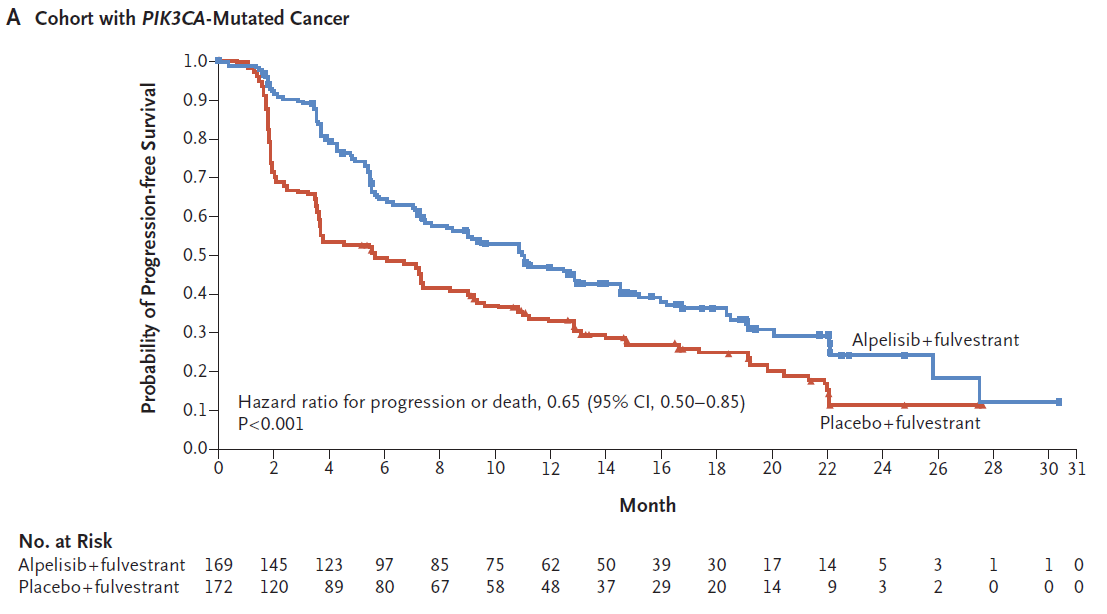
Andre F, Ciruelos E, Rubovszky G, Campone M, Loibl S, Rugo HS, et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med. 2019;380(20):1929-40.
実際の論文には図のような結果が示されました。
PIK3CA遺伝子変異陽性の腫瘍を持つ再発患者さんが、フルベストランとアルペリシブによる治療を受けられた場合、フルベストラント単独と比較して、5.7か月から11.0か月も進行を遅らせることがわかりました。たった5か月程度と思われるかもしれませんが、ほぼ倍に伸びています。それから言えば1年で進行する方なら2年に延びる可能性がある、と考えると非常に良好な結果であるといえます。
ただ同時に行われたPIK3CA遺伝子変異のない方での検討では残念ながら差が認められませんでした。
3でも示されているように、PIK3CAというバイオマーカーを参考にして、それが陽性であればアルペリシブが効果があります。
また以前紹介したようにBRCAというバイオマーカーを参考として、それが陽性であればPARP阻害剤、具体的には日本ではリムパーザが効果があります。
以前はホルモンレセプター(HR)、あるいはHER2、この二つが代表的なバイオマーカーでしたが、今ではこれに加えてPIK3CA、BRCA、さらに免疫チェックポイント阻害剤のバイオマーカーであるPD-L1が加わったことになります。単純にHR陽性陰性で2、HER2の陽性陰性で2、と2の5乗、32種類のがんが分類されたことになり、治療も応じて複雑化してきています。将来は次世代シーケンサーで一気にバイオマーカーを検査して、適切な治療法をAIが提示してくれる、そんな風になりそうです。
現在、日本で保険適応とされているのは2だけになります。
3は一部で可能になっています。ただ文面からはPIK3CA変異の検査はルーティンとして施行するべきと書かれていますが、日本では保険収載されていません。またこれが可能になっても、それに対応する治療薬剤のアルペリシブが保険収載されていないため、もうしばらく待たないといけません。
またアルペリシブによって高頻度(3割以上で比較的重症になるとされます)に認められる耐糖能異常のコントロールについても、実際の使用に際しては、発生したときに対応をどうするか、しっかり対策を立てておく必要があるでしょう。
ただこうした道筋が見えていれば、何もない暗闇で待つよりも光が見えています。COVIDのワクチンで分かるように、必要とあれば数か月で臨床導入されるのですから、あきらめるのは早いと思います。
朗報を待ちましょう。
皆さんはブレスト・アウェアネスという言葉を知っていますか?
長い文章を読んでいる時間のない方に、最初に結論から言います。それほどこの考え方は大事です。
「異常を見つけるためには、まず正常な状態を知らなければ見つけられない」
(乳腺の異常を見つけようと思うなら、まず正常な自分の乳腺の状態を把握しておこう)
ブレスト・アウェアネスはこういう意味になります。
正常な乳腺であることが確約されている日、つまり検診を受けてこの記事に到達したその日にしっかり自己検診をしておき、正常と診断された自分の乳腺の状態を把握しておく。
あとは定期的に触って、今日なかったものは何か触らないか、感じないか、それを探すのが自己検診なのです。
*****************************************
乳がんは自分でも検診できるがんです。
自覚症状が出現して見つかったがんは早期ではない、は一般の方もよく知っています。がんは初期には症状はないことが多いのです。ですので症状が出現している時点でそれががんだったなら進行がんのことが多いのです。
ただ、乳がんの自己検診は違います。自分で正しく検診してがんを見つけたなら、早期発見されている可能性のほうが高い。その意味からも、そして30歳代から60歳くらいまでで、もっとも罹患率の高いがんである乳がんを、自己検診しないのは何とももったいない話です。
私のクリニックに検診に来られた方に、自分でも自己検診してください、と勧めています。
ただたいていの方は、触ってもよくわからないから…と濁されます。
わからないからやらない。
健康な方は当然乳がんを触ったことがありません。わからないものを手探りで探しに行っても何もわからない、当然です。アサリがどんなものか知らない子供が潮干狩りに行って、砂の中を探しているようなものです。カニでも石でもなんだって拾ってくるでしょう。お母さん、これアサリ? アサリはこれだよ、お母さんが見せてあげて、初めて見つけられるようになります。それでも死んだ空っぽの貝殻を拾ってきたりしますよね。
いままで乳がんに罹患したことのない方が、乳がんがどんなふうに硬く、しこって触るのか、知るはずはありません。だからわからなくて当然です。がんを探しに行くからわからないのです。


わからないからやらない、そういう方の考え方を変えてしまう概念、それが
ブレスト・アウェアネス(Breast Awareness)です。
Awarenessは、訳すと”気づき”とか”認識”となります。”自分の乳腺を知ること”と訳します。
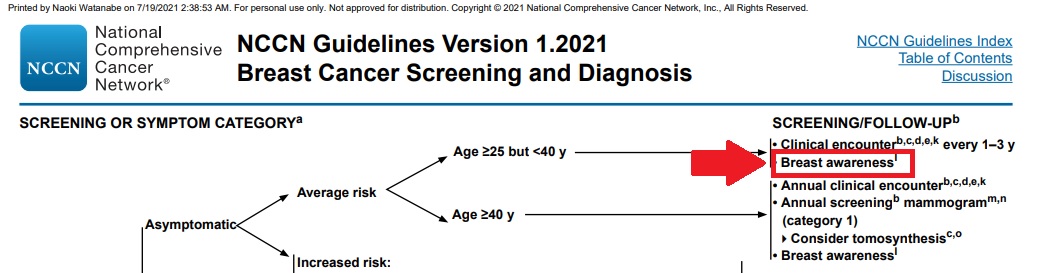
これは私がよく引用している米国の乳腺の検診と診断のガイドラインの一部です。(もし見られない方は日本語版がありますので参照してください)
ここにブレスト・アウェアネスの言葉が出てきます。参考までに訳してみると、「特にリスクのない、25歳から40歳の女性は1-3年ごとに医療機関を受診し、ブレスト・アウェアネスに気を付けてください」と書かれています。少なくとも米国では乳がんの自己検診において、ブレスト・アウェアネスは教科書レベルの言葉と言えます。
ここでは 私なりの言葉で皆さんにわかりやすく、このブレスト・アウェアネスという言葉を解説してみたいと思います。
まずどこでもいいので、医師が診察してくれて、医師と話の出来る環境で乳がんの検診を受けてください。もし自分で何らかの所見に気が付いていたり、症状があればその際に必ず医師に相談してください。
ドックや会社検診で写真だけ取ってあとから結果が帰ってくる検査はここでは含みません。医師と話ができることが重要です。
マンモグラフィ検査を受けたら、自分の乳腺の濃度を教えてもらって把握しましょう。
(高濃度乳腺とは -Are You Dense?ー を参考にしてください。)
もし高濃度乳腺であれば、マンモグラフィ検査だけでは不十分なことがあります。
乳腺超音波検査、場合によってはMRI検査などが必要なら受けましょう。これらによって、ここが硬いな、ここは時々痛いな、そんな自分の気になる症状がある方はそれが悪性ではないことを確認しましょう。そして正常な乳腺であることを確認することがまず前提になります。
帰宅したら、今日の入浴の際に、改めて自己検診をしてください。
できれば生理が終わって1-2週間が理想ですが、そうも言ってられないと思います。インターネットを調べて自己検診のやり方を調べられる方もおられるでしょう。それもいいアイデアです。ただやり方は問いません、とにかく今日、自分の乳腺の全体を触ってみましょう。
触っているとき、どこかが硬いと感じるかもしれません。ここは痛いな、と感じるかもしれません。改めて気になる所見が見つかるかもしれません。ただそれらすべてが貴方の正常な乳腺の状態です。
つまり、異常なしと診断された、その日に自己検診を行い、自分の正常な乳腺の状態を把握(認識、精通、熟知=アウェアネスです!)しておくことが重要なのです。
それからは できるだけ生理周期も同じ時期を選んで、さらにやり方も同じやり方で、月に1回は自己検診してみましょう。
もし今日の自己検診でなかった所見が、将来見つかったら、それを異常と考えます。
間髪おかず、かかりつけ医に相談しましょう。
つまりがんを探すのではなく、今日と違っているところはないか、探すのです。
乳がんは原則として痛くもかゆくもありません。ただ硬く、しこりを感じる、それが典型的な症状なのです。裏を返せば触っておかなければ見つかりません。早期の乳がんが、痛みやかゆみ、違和感など、自覚症状で存在を教えてくれることなどないのです。ばれないように、みつからないように、そっと潜んでいる、そう認識してください。見つけに行かないと見つからないのです。そこで武器になるのが、正常な自分の乳腺の状況をアウェアネスしておくことになります。
正常な状態を知っているから異常な状態に気が付くことができる。
異常を探すのではなく、正常な自分の乳腺を覚えておいて、現在の乳腺を比較するのです。
たとえ乳がんを触ったことがなくても、自分の乳腺の正常な状態を把握しておけば、異常には気が付くことができるのです。もちろんそれが乳がんとは限りません。ただ以前はなかったものが何かできている、現れた、それが重要な所見、気づきになります。


先に触れた米国のガイドラインは、
症状がなく、さらに遺伝性の要因、出産授乳経験がない、肥満がない、などリスクのない方で、25歳から40歳の女性は1-3年に1度 医療機関を受診し、異常のないことを確認すること。
そしてその際に自分の正常な乳腺の状態をアウェアネスし、自己検診を行う中でもし異常を見つけたら間髪おかずに医療機関を受診すること。
と書いてある、ということになります。
追加の記事を書きました。時間があれば、これらも読んでみてください。
1.ブレスト・アウェアネス もう一度
2.乳腺あるある よく誤解されていることシリーズ 第3回 自己触診しろって言われますが、乳がんって触ってわかるんですか?
4. 最新記事!です
ピンクリボン ブレスト・アウェアネスについて
2021.07.08
BRCA1/2遺伝子にバリアントがあるために引き起こされるHBOC(遺伝性乳がん卵巣がん症候群)が関与する割合は、乳がん患者さん全体の4%前後とされています。トリプルネガティブ乳がん患者さん全体ではどれくらいの方が関与されているかについて、日本人のデータはほとんどありません。ただ今年、大阪国際がんセンターから出されたデータによれば、最近7年間 65人のトリプルネガティブ乳がん患者さんを調査したところ、13人(20%)がBRCA1/2遺伝子バリアント陽性であったとのことです [1]。
ちなみに北米やヨーロッパの100名を超える大きなデータベースでは9.3から15.4%とされていますから[2,3]、日本ではそれよりも高い可能性があります。しかし我が国のデータはあまりに数が少ないため、それは今後の調査を待って結論が出るでしょう。ただトリプルネガティブ乳がん患者さんでは、HBOCが関与する比率が、乳がん患者さん全体と比較して高い、ということはすでに確立した概念です。
確固とした治療の標的を持たないことがその名前の由来であったトリプルネガティブ乳がんですが、少なくとも2割弱の方では、HBOCの検査を受けられることによって、治療の標的が見つかる、ということがわかります。HBOCにおけるBRCAの遺伝子バリアントは、現在ではすでに治療の標的なのです。その意味からはもうトリプルネガティブ乳がんというのは失礼かもしれません。ER陰性、PgR陰性、HER2陰性、BRCAバリアント”陽性”乳がんです。
そしてそれが大きなメリットになりつつあることはいままでもこのブログの中で触れてきました。
(トリプルネガティブ乳がんと免疫チェックポイント阻害剤 その2)
ちなみにHER2陽性乳がん患者さんでは、治療目的にBRCAバリアント検査がなされることは原則ありません。HER2陽性患者さんにも少なからずBRCAバリアント陽性の方がおられるはずですが、BRCAを標的とする治療は原則施行されません。HER2という確固とした標的がすでにあるからです。
ここではがん治療において、標的がある、標的がない、とはどういうことなのか、もう一度整理してみようと思います。それを知ることで、おのずと遺伝子を検査するメリットが見えてくるはずです。


皆さんは学校の職員です。先生としましょう。
教室の生徒の中に悪い子がいます。いつも悪さばかりするので、先生であるあなたは懲らしめたい。そこでその子だけおなかが痛くなるような給食を作りたいと考えました。もちろんその子だけに何か別の給食を作ったら変です。みんな同じ給食を食べるのですが、その悪い子だけにはおいしくない、おなかが痛くなる、ほかのみんなは何ともない、そんな給食の献立はどこかにあるでしょうか?
まず思いつかないと思います。現実はもっと厳しくて、この生徒たちは皆双子、三つ子、四十つ子で同じ遺伝子を持っています。そして悪さしている子だけ懲らしめたい。そんな献立です。抗がん剤を作る、というのはそれによく似たことなのです。
そりゃ無理だ。でも実際抗がん剤は存在して、治療しているじゃないか、それはどんな理屈なんだ?
そう思われる方もおられるでしょう。
現在存在している抗がん剤のうち、以前から存在している薬剤、ここでは”分子標的薬剤”を除く、と考えてください。こうした抗がん剤はどのようにしてがん細胞を懲らしめているのか。
先のたとえで言うならば、みんなの小遣いを一気に減らしてしまいます。そうすれば悪い子が夜中に悪さをするためのお金が無くなって、悪いことができなくなるだろう、今の抗がん剤はそんな感じです。だから他の普通の生徒たちもたとえば参考書が買えなかったり、部活動ができなかったりします。いわゆる副作用です。
そう考えれば抗がん剤の開発が難しく、同時にどうしても副作用から逃れにくいことが理解できると思います。
普通の細胞と、がん細胞を区別するものが何かないか。
普通の細胞にはないのに、がん細胞にはあるもの。逆に正常細胞にあるのに、がん細胞にだけ存在しないもの。そうしたものを何とか探し出せないか、生物学者が必死に探し続けているものです。それが見つかればその細胞にだけ、栄養を与えず、毒を渡してしまえばいいのです。(ごめんなさい、学校のたとえはその意味ではちょっとよくないですが、御容赦ください)
乳がん細胞のそうした標的の一つがホルモンのレセプターです。
え、正常細胞にはホルモンのレセプターはないの? もちろんあります。
ただ女性ホルモンのレセプターを出している細胞は、女性の性機能にかかわる細胞に主に出現しています。がん細胞以外の正常な細胞であっても、性の活動、妊娠、出産、授乳など、そうした活動をしなければ一緒に攻撃してしまっても問題ありません。もちろんホルモン剤を使用しながら妊娠をすれば重大な問題が起こります。ただそうでなければ、男性が元気に暮らしていけるように、女性の性の活動以外の生活には大きな問題が生じないのです。(注 女性ホルモンをブロックしたからと言って男性にはなりません。男性ホルモンは出ないからです。)
このように標的があれば、それを狙う薬を作る。それが成功すれば治療の劇的な効果と、副作用の強力な抑制が可能になります。極端な話ですが、たとえ効果がそれほど高くなかったとしても、副作用が少ないのであれば、効果が得られるまで、どんどん薬の量を増やしていけばいいのです。標的とそれを狙う薬剤、多くは分子標的薬剤と呼ばれます、この二つが揃えば、恐ろしい病気であるがんも治療できるのです。
標的: ホルモンレセプター 薬剤: ホルモン剤(これも広い意味で分子標的薬剤です)
標的: HER2蛋白 薬剤: 抗HER2分子標的薬剤
こうしてペアで考えればがんの治療薬の理解はわかりやすくなります。乳がん治療の大きな柱であるこの二つのペア、その標的の両方を持たないことからトリプルネガティブ乳がん治療は難しいとされてきたのです。
現在もトリプルネガティブ乳がんでの標的探しが続いています。
ただいま標的と薬剤のペアが揃っていて、効果も証明済のものとして
標的: PD-(L)1 薬剤:免疫チェックポイント阻害剤
標的: BRCA遺伝子バリアント陽性のおけるPARP 薬剤:PARP阻害剤
という新たなペアが見つかったといっていいでしょう。もちろん保険収載されています。
特にいままで標的がないとされてきた、トリプルネガティブ乳がんにおいては重要な治療の選択肢を与えるものになった、ということなのです。
標的と、それを狙う薬剤のペアで構成されるがん治療は、効果が高く、副作用が軽い特徴があります。現在でも効果が完璧かつ、副作用が0の理想の薬はまだありません。それができればがんは根治可能になります。ただそれは大変難しい。たとえば外からやってきて、悪さをするウィルスであっても、それを狙う抗ウィルス剤には副作用があります。先にふれたとおり、がん細胞は紛れもない自分の細胞であり、外から来たものではありません。その行動パターンが正常範囲を逸脱しているだけです。異常な増殖、や、多臓器への転移がそれです。したがって異常な増殖をターゲットにしたとしても、正常な傷を治す働き、髪の毛の毛根細胞などにはダメージがあります。がん細胞が使っているシグナルや機能は、正常な細胞も使うことがあるからです。がん細胞における標的は、名札のような単純なものではありません。正常な細胞であれば”めったに”出すことはない、それがまれであればあるほど優秀な標的である、と言えます。ただかならず正常な細胞もその標的を持っているのです。
免疫チェックポイント阻害剤、PARP阻害剤も副作用はあります。ただ効果に比して軽いものであるか、頻度が低いことがわかっています。トリプルネガティブ乳がんの治療において大きな前進があった、そう言えると思います。
このことが陽性とわかった時のメリット、現在ではその最大のものでしょう。
ここまで読まれた方であればよければもう一度、下記の記事を読んでいただければより理解が深まると思います。(トリプルネガティブ乳がんと免疫チェックポイント阻害剤 その2)
1. Fujisawa F, Tamaki Y, Inoue T, Nakayama T, Yagi T, Kittaka N, Yoshinami T, Nishio M, Matsui S, Kusama H et al: Prevalence of BRCA1 and BRCA2 mutations in Japanese patients with triple-negative breast cancer: A single institute retrospective study. Mol Clin Oncol 2021, 14(5):96.
2. Armstrong N, Ryder S, Forbes C, Ross J, Quek RG: A systematic review of the international prevalence of BRCA mutation in breast cancer. Clin Epidemiol 2019, 11:543-561.
3. Emborgo TS, Saporito D, Muse KI, Barrera AMG, Litton JK, Lu KH, Arun BK: Prospective Evaluation of Universal BRCA Testing for Women With Triple-Negative Breast Cancer. JNCI Cancer Spectr 2020, 4(2):pkaa002.
2021.06.28
この記事は、「遺伝性のがんという概念」の記事を読まれた方を対象にしています。
また乳がんの診断がついておられる方であっても、今まさに術前で主治医の先生と治療の相談をされている方は対象としません。疑問があれば主治医と納得いくまで話し合うべきだからです。
「遺伝性のがんという概念」記事の最後に述べましたが、BRCA1、そしてBRCA2の遺伝子バリアント検査は、乳がんをすでに罹患された、遺伝性の乳がんの可能性の高い方に限り、保険適応が認められています。
そして患者さんにとって、自分はすでに乳がんに罹患したのに、その上乳がんの遺伝子バリアントを持っていることを調べることに意味はあるのか、は大変な疑問だと思います。
たとえどんな検査であっても、たとえそれが病気の治療であっても、われわれは希望されない方にそれを行うことはできません。まして保険が適応されていたとしても、保険を支払っている皆さんが希望もされない検査や治療を施行できません。そして保険が適応されたとしても、少なからず検査や治療には自己負担があります。したがって検査を提示するにはそれによってどんな利益があるのか、患者さんが納得しなければ誰も検査は受けません。
そこでこの記事では、遺伝子バリアント検査を受けることのメリットを中心に触れていきたいと考えます。
ちなみにだれでも思いつくメリットの一つに、温存切除を受けられた方であれば残された乳房、そして全摘をされていても対側の乳房の乳がんの発生リスクがわかる、というメリットがあります…①
ただこのメリットは患者さんはあまり魅力がないようです。というのも、最初の乳がん以降は定期的に乳がん専門医に通院しつつ、診察や検査、もちろん対側の検診も受けておられる方がほとんどだからです。ちなみにBRCA遺伝子バリアントを有する方では予防的に乳房を切除することが保険で認められています…②。これもメリットの一つになりますが、片方の治療を受けたばかりで、今のところは異常も認められていない状況で、すぐに対側の切除を希望する方は少ないでしょう。(この記事の対象ではありませんが、もし貴方が手術前であれば、そして乳房を温存するか、全摘するか、悩まれているとすれば、その決定に影響する可能性があります。もしBRCA遺伝子バリアントを有することが術前に判明していれば、思い切って全摘して、再建を視野に入れる、そうした考えを持たれる方もいるでしょう。)
BRCA遺伝子のバリアント検査を受ける際には、保険収載の際の決まり事として、検査の前に専門の資格を有する医師、あるいは認定看護師にカウンセリングを受ける必要があります。カウンセリングでは、検査の内容、かかる費用や日数、もし陽性と診断されればどうすればいいのか、陰性ならもう何も心配はないのか、など、多岐にわたって説明が行われます。場合によってはBRCA遺伝子以外のがん遺伝子のバリアントの可能性についても指摘され、専門医に紹介してくれることもあるでしょう。
私自身は、遺伝の専門知識をもつ医療従事者からカウンセリングを受けることができる…③、このことが最大のメリットである、と信じて疑いません。
今すぐ検査を受けようと思われない方であっても、もし陽性だったらいつかは困ったことが起こるかな、とちょっと不安に感じることがあるではないでしょうか。なにより、もし自分の身近な血縁者、ご姉妹や娘さん、姪御さんが乳がんと診断されたらどうしよう、やっぱり遺伝なのかな、と折に触れ、不安に感じておられるのではないでしょうか。なによりすでにそう思われて、「遺伝の検査なんて受けなくても、娘には毎年検診を受けるように口酸っぱく言っています」そういわれる方もおられます。でももしご自身がBRCA遺伝子バリアントを有していて、娘さんも同じようにBRCA遺伝子バリアントを有していたとしたら、娘さんの検診はどのようにするのが適切なのでしょうか。クーポンで2年に1回は検診を受けている?それで大丈夫でしょうか?
危険な山、エベレストを登るときと、そのあたりの山、増位山を登るときでは準備が全く異なるように、BRCA遺伝子バリアントを有する方では、乳がんの検診を始めるべき年齢も、回数も、そして内容もバリアントのない方とは異なります。そして乳がんの検診だけを考えていても不十分なのです。
「私は医者じゃないのだから、そんなことを言われてもわからない!」
もっともだと思います。それでも娘さんのことは心配なはずです。検査をしたほうが良ければ正しく検査を受けてほしいはずです。ですので、ご自身が専門の医療従事者のカウンセリングを受けられる際に、その娘さんと一緒に受診されればいいのです。一石二鳥です。
確かに娘さん(姪御さんやご姉妹に置き換えてもらって構いません)は乳がんになっていないので、カウンセリングだけであっても保険は適応されません。ただお母さんに付き添って話を聞く分には問題ありません。出て行け、とは言われません。もちろん質問しても無視される、なんてことはありません。
そうしておけば、いつか娘さんになにか困ったことがあった時、どこに相談すればいいのか、貴方がいなくてももう悩むことはなくなります。検査を受けたいと思ったらどこに相談すればいいのかも、もう悩みません。その意味からは、もう私は年だから、この先乳がんになろうが、どんながんになろうが構わない、そうおっしゃられるご高齢の方であっても、このメリットは共通です。今後、遺伝関係で困った時にどこに相談すればいいのか、ご自身もご家族も知識として得ることができる…④ このことはおそらくすべての方に共通のメリットになるはずです。そして実際には検査を受けなかったとしても得られるメリットです。
その意味からはせめてカウンセリングだけは受けておきましょう。
陰性と診断された際のメリットはわかりやすいと思います。
今後の検診は、今回の乳がんに関するものを除けば特別なものは必要ありません。今まで通りで問題ありません。今回の乳がんは偶然のなせる事故であって、遺伝からくる必然ではなかったのですから。
そして血縁者の方にとっても、同様に大きなメリットがあります。
現在たとえ健康な方が受けられるドックや健診であっても、家族歴の聴取は重要とされています。たとえば貴方が40歳で両側の同時乳がんに罹患されたとします。現在4親等の親族までは血縁者として家族歴聴取の対象ですので、従兄妹、姪御さんも検査や健診を受診されると、貴方の存在が注目されます。そして特に乳がん、卵巣がん、そして男性であっても前立腺がんなどについて、より若くから検診を始める、頻度を年1回から2回にするなど、厳重な検査と経過観察が勧められることになり得ます。おそらくそれは貴方が寿命を終えられたとしても終わりません。担当する医師としては、貴方の陰性が証明されていない限り、血縁者に関して、BRCA遺伝子バリアント陽性を念頭に置いてリスクマネージメントすることがほとんどだからです。
逆にもし陰性と診断されていたのなら、たとえば娘さんは「母親は40歳で両側乳がんに罹患しました。ただHBOCに関する検査は完了していて、陰性と診断されています」と表明することで過剰な検査を避けることができる可能性があります。それによって生じるコスト削減効果は将来にもわたるため、最終的に貴方が支払う遺伝子バリアント検査費用よりもいずれ大きくなるでしょう。
つまり陰性と確定していれば、貴方、そしてあなたの血縁者は、本来は不要である、より密度の高い検診を受けなくてもよくなる…⑤のです。これも貴方の年齢や、今まさにがんであるかどうかに関係しないメリットになるでしょう。
陽性と診断された場合、いままさにトリプルネガティブ乳がんと診断された方、のメリットは次回にさらに掘り下げたいと思います。
がんは基本的にすべて遺伝子の異常によって引き起こされます。遺伝子は親から子供に引き継がれる体の設計図です。人に限らず生き物は全てもともと1個の卵細胞から、分裂して増殖した星の数ほどの細胞から構成されています。ですので、体を構成しているすべての細胞の中には同じ設計図が入っています。ただ設計図があっても、それを全て作るわけではありません。目なら目、足なら足、筋肉、血管、血液細胞など、それぞれがそれぞれの設計図を引っ張り出して都合よくパーツを作り出しているのです。
親から引き継がれた遺伝子の異常をかんがえましょう。ただここで注意してほしいのは、現在の科学では、遺伝子の個性がすなわち本当に”異常”と言い切っていいのかはまだわかりません。個性の範囲内かもしれません。われわれは黒髪ですが、金髪の遺伝子を持つ人もおられ、当然遺伝子が異なります。けれども金髪の遺伝子は、われわれと異なりますが、異常ではありませんよね。ただこれから触れていく遺伝子は、がんと関係が深いことがすでに証明されている遺伝子ですので、異常としているだけです。もしかするとそれはそうでも、引き換えに遺伝性のとても素晴らしいギフトがあるかもしれません。その意味からは異常という言葉を使うことは本来間違いともいえます。専門家はそういった理由から、異常と呼ばず、バリアントと呼びます。バリエーションの一つという意味です。難しい横文字をわざわざ使いますが、ご容赦ください。
遺伝子の中にBRCAと呼ばれるものがあります。この遺伝子はがんの遺伝子ではなく、がんを抑制する遺伝子です。ですのでバリアントがあれば、さまざまな臓器のがんになりやすくなります。体の細胞すべて同じ遺伝子ですので、BRCAの異常はすべての細胞で引き継がれています。そしてこの遺伝子のバリアントを有する方では乳がん、卵巣がん、男性では前立腺がんにかかりやすい傾向があります。BRCA遺伝子のバリアントを有して、乳がんや、卵巣がんに罹患することを、遺伝性乳がん卵巣がん症候群(HBOC)と呼びます。
BRCAの遺伝子にバリアントがあれば乳がんや、卵巣がんに罹患しやすいということは触れました。
逆に乳がんに罹患しやすい遺伝子のバリアントには、現在BRCA1、BRCA2に発生した変異で引き起こされるHBOCがその代表ですが、TP53の遺伝子変異から引き起こされるリー・フラウメニ症候群、PTEN変異から引き起こされるカウデン症候群、CDH1変異から引き起こされるものが知られています。
| 症候群の名前 | 変異がある遺伝子 | どの臓器のがんになりやすいのか? |
|---|---|---|
|
HBOC |
BRCA1 BRCA2 |
乳がん、卵巣がん、前立腺がん、 膵臓がん、 黒色腫 |
| リー・フラウメニ症候群 | TP53 | 軟部組織肉腫、骨肉腫、脳腫瘍、 乳がん |
| カウデン症候群、 | PTEN | 乳がん、子宮体がん、甲状腺がん、 大腸が ん、腎細胞がん |
| CDH1 | 胃がん、乳がん |
ここで勘違いしやすいのは、乳がんの大部分はこうした生来の遺伝子のバリアントから引き起こされるものではなく、いわば”事故”である、ということです。乳がん患者さん全体で見たとき、それがHBOCとして発生している確率は4%前後である、とされます。
お母さんが45歳の時に交通事故にあった。だから自分も45歳の時は交通事故に気を付けよう。この考え方がおかしいように、乳がんの95%はこの事故と同じです。
お母さんもおばあちゃんも二重瞼だった、だからきっと私の子供も私と同じ二重瞼だわ、ということと同じように乳がんに罹患してしまわれることが、乳がん患者さんの20人に一人の乳がんで起こっている、ということです。
そのことからわかるように、血のつながった人で乳がんの人は一人もいない、自分が血縁者の中で初めて乳がんに罹患された、それも80歳になってから罹患された方と、お母さんも40歳台で乳がん、おばあちゃんも40歳台で乳がんで、自分も40歳台の若くして乳がんに罹患した方を比べれば、そうした遺伝子のバリアントで乳がんになってしまった確率、つまりHBOCである確率は、後者ではるかに高くなります。
またHBOCでは、乳がんは自分しかいない、けれどもお父さんは膵がん、前立腺がん、そしてその父方おじいちゃんも膵がんだった、とすれば乳がんの血縁者がおられなくても、確率は高いと考えられます。
このように、血縁者でどのような臓器のがんの方がおられるか、またそれは何歳の時に発症されているか、を調べることで、こうした遺伝性の異常がある方かどうか、ある程度確率を推測、計算できるようになります。
下記の項目の中で1つでも当てはまる場合は、HBOCの可能性が 考慮されます。
| BRCA1, BRCA2遺伝子の検査を受けて、陽性であることがわかっ ている方の血縁者 |
|---|
|
ご自身が乳がんであり、かつ以下のいずれかに該当 する |
| ご自身が男性で乳がんと診断された方 |
| ご自身が卵巣がん・卵管がん・腹膜がんと診断された方 |
| ご自身が膵臓がんと診断された方 |
| ご自身が転移性の前立腺がんと診断された方 |
ちなみにここでいう血縁者とは父母、兄弟姉妹、異母・異父の兄弟姉妹、子ども、おい・めい、父方 あるいは母方のおじ・おば・祖父・祖母、大おじ・大おば、いとこ、孫などを含みます
そして2021年6月現在、ご自身がすでに乳がんに罹患されており、下記に該当する方では、希望すれば保険をつかって、ご自身がBRCA遺伝子のバリアントを有しているかどうかを調べることができます。
もちろん自費であれば、だれでも検査を受けることは原則として可能です。
検査は体のどこの細胞でも可能です。ただもしその材料に他人の遺伝子が混ざっていれば誤った診断になります。髪の毛だと理髪師の方の遺伝子がついているかもしれません。純粋な自己細胞のみを採取するため、血液を採取して遺伝子の検査は行われます。逆に検査に必要なのは血液だけです。
| 45歳以下で乳がんと診断された方 |
|---|
|
60歳以下でトリプルネガティブの乳がんと診断された方 |
| 両側の乳がんと診断された方 |
| 片方の乳房に複数回乳がん(原発性)を診断された方 |
| 男性で乳がんと診断された方 |
| 卵巣がん・卵管がん・腹膜がんと診断された方 |
| 腫瘍組織によるがん遺伝子パネル検査の結果、BRCA1、2遺伝子 の病的バリアント(異常)を生まれつき持っている可能性がある場合(これは血液検査ではなく、乳がん組織を調べたらBRCA遺伝子の異常が認められた方という意味です。生来の遺伝子異常は持たれていなくても、事故として発生した乳がん組織だけにおいてBRCAの遺伝子異常を有していることがあります) |
| ご自身が乳がんと診断され、血縁者(これは上記と同じです)に乳がんまたは卵巣がん 発症者がいる方 |
| ご本人が乳がんと診断されたことがあり、かつ血縁者がすで にBRCA1、2遺伝子に病的バリアントを持っていることがわかっ ている場合 |
こうして遺伝子検査を受けられ、BRCA1、あるいはBRCA2陽性と診断された場合、乳がんに罹患する確率は60歳までで5割、つまり約半分の方が乳がんに罹患され、さらに80歳までには7割の方が乳がんに罹患する確率があることがわかっています。
ただここまで読んでこられた方で、疑問に思われている方がおられるはずです。
「もう乳がんに罹患したのだから、それから保険が通るからと言って、遺伝子を検査することに意味はあるのか?すでに乳がんに罹患して苦しんでいるのに、さらに遺伝的のバリアントがわかったところでさらに苦しむだけのことで、なにが得られるというのか?」
それについて、とくにトリプルネガティブ乳がんと診断された方を中心に、いままさに利益がある方がおられることがわかっています。
またそうでなくても、わが国ではさまざまな保険診療のサポートを受けながら、これから起こり得る病気と向き合っていけるようになるメリットもおおく享受できます。
次回話をしていきたいと思います。
なおここまで読まれて興味がある方は、ぜひ日本遺伝性乳がん卵巣がん総合診療制度機構の提示しているパンフレット 「遺伝性乳がん卵巣がん症候群(HBOC)をご理解いただくために」もご参照ください。
この記事は、BRCA遺伝子変異を有する、と診断された乳がん患者さん向けに書かれたものです。とくにトリプルネガティブ乳がんの方には関心のある話題となるでしょう。しかしそうでない方には難解な内容が含まれます。興味のある方はこのサイトを参考にしてください。(遺伝性乳がん卵巣がん症候群(HBOC)をご理解いただくために)
今年も米国シカゴにて、世界最大といっても過言ではない臨床腫瘍学会、がんの基礎研究ではなく、臨床の実践における研究の発表の場であるASCOが開催されています。
乳がん分野における注目に値する最新の研究結果を患者さんにわかりやすく提示できればと思っています。特に本年ではプレナリーセッションと呼ばれる、”絶対に知らなければならない、無視はできない”と学会本部が認めた今年最も重要な研究結果の発表の中に乳がんに関するものがありました。それはBRCA遺伝子変異のある方(アンジェリーナジョリーで有名になりました)が、進行した乳がんで発見された場合、オラパリブ(商品名 リムパーザ🄬)を再発予防の目的で、1年間飲んでおけばどのような影響があるか、本当に再発はすくなくなるのか、にこたえる研究結果です。
ちなみに現在オラパリブは再発乳がんの治療に使用され、すでに大きな成果が上がっています(私が以前書いた記事を参考にして下さい。”Triple Negative乳ガンの新しい薬剤”)それならば再発をしないように、再発される可能性の高い方に、再発する前から使用しておけば、再発そのものをしないようにできるのではないか、目に見えない転移の段階で使えば、撲滅できるのではないか、という疑問に答える研究です。
ただもちろんその中にはもともと飲まなくても再発しない方、手術で完全に治っておられる方も含まれます。そのため、それによって大きな副作用があってはなりません。生活に与える影響や副作用を含めた安全性も同時に慎重に調査されました。合計で1836名の患者さんを、予防的にオラパリブを飲む群と、プラセボ(偽薬)を飲む群にランダムに分け、予後を追跡したのです。このようにすると、患者さんも医師も、その患者さんがどちらに振り分けられているかわからないため、さまざまなバイアス(予後に与える影響)を排除し、より精度の高い純粋な結果を得ることができます。こうして完璧に準備された研究で、疑いようのない、決定的な結果が得られました。
小さい絵に情報を盛り込んだため、専門用語を使わざるを得ませんでした。上記はフローチャートと言われるもので左から右に見ます。こうした方たちを〇で囲んだところで1:1に分けて片方にオラパリブ、片方に偽薬を投与した、ということを略図を使って表現しているものです。試験のデザインですので基本となる重要なものです。
Germline:がんの部分に遺伝子異常があるのではなく、生来の異常がある方
HR:ホルモンレセプター(これがある方にはホルモン治療を行う)
non-PCR:術前化学治療をしてもがんが消えなかったという意味です。
今回の試験の対象とされたのは、まず遺伝性の異常(BRCA)を有している方で、HER2陰性で、化学治療を必要とされる比較的進行した乳がんの方、であることが示されています。現在は手術前に抗がん剤される方もおられます。もしそれでがんが消えてしまえば予後がいいことが知られています。それでもがんが残ってしまった方が試験の対象とされました。
NAC:術前化学治療
RCT:ランダム化前向き試験
PrimaryとSecondary:この試験で確認したい最大の課題、と、副次的に証明される課題
CPS+EG Score:これは彼らの独自の分類で、乳がんにおける病期(早期、末期など、数が大きければ進行がんで、かつ予後不良となる)
この試験では最終的に 平均年齢は42-3歳の方が参加されました。
BRCA1異常の方が70%前後、BRCA2異常の方が30%前後でした。
最終的にホルモンレセプター陽性の方が2割程度、8割の方がトリプルネガティブとよばれるホルモンレセプター陰性でした。HER2陽性の方は慎重に除外されています。
術前に抗がん剤を受けられた方、術後に抗がん剤を受けられた方が半々でした(この試験は、もともと抗がん剤の適応があるような進行したがんの方が対象ですので、参加された全員が何らかの抗がん剤投与を受けられています)。
結果です。
3年間追跡して調査したところ、再発は104例→65例に抑えることに成功しています。ハザードというのですが、0.61(99.5%信頼区間として0.39~0.95)と示されました。それは本来100でおこる再発を61にまで抑える、という素晴らしい成績だったのです。
遠隔転移(肺や骨、脳、肝臓への転移)はハザード0.57(99.5%信頼区間として0.39~0.83)で抑制されました。
生存率に関しても、ハザード0.68(99.5%信頼区間として0.44~1.05)で死亡される確率が抑制されました。がんの再発や、転移が認められたらもちろん治療をその後に行います。そのため、再発や転移を抑制できても、その後に行われる治療が影響するために、最終的に生存率そのものが改善することは、実は難しいのです。今回は、再発、転移の抑制効果が大きかったために、生存率でみても差があった。文句のつけようがない素晴らしい結果です。
今後 BRCA遺伝子変異が証明された方で、再発の危険性が高いと判断されて、抗がん剤治療を要した方では、その後に予防的にオラパリブを1年間飲用使用しておくことが勧められるでしょう。ただ現時点ではオラパリブを用いた予防的治療は保険収載されていませんが、近い将来には収載される可能性があります。それからはこうした治療が当然のことになる可能性があります。
この傾向はトリプルネガティブ乳がんの方でより強く認められたことも付記しておきます。
続き(この記事は乳がん術後、とくにトリプルネガティブ乳がんについてある程度知識を持っておられる方を対象に書かれているため、一般の方には難解です。また知識がおありの方も、できれば姫路赤十字病院ホームページで私が書いたトリプルネガティブ乳がんの記事を読まれた後で読んでいただくことで理解が深まると思います。)
http://himeji.jrc.or.jp/category/diagnosis/nyusengeka/topics/20170912_1.html
ここまで免疫チェックポイント阻害剤(ICI)がトリプルネガティブ乳がん、それもPD-L1をがん細胞が提示していて、リンパ球の攻撃から逃れている可能性があれば、いままでの抗がん剤のみの治療と比較して、効果があることが証明されたことの話をしてきました。
再発、転移乳がんの治療は、しかし延命治療のニュアンスがあるため、皆さんの中には数か月余命が伸びたところでと思われる方が多いかもしれません。ただ、たとえば手術前後の治癒する可能性が高い患者さんに、こうした新薬を使って万が一でも今までの治療よりも結果が劣ることになれば、そのことはすなわち治癒するべき方を治癒できなくした、ということになります。順序として再発・転移の進行した乳がん患者さんで延命効果が証明された薬剤でなければ、手術前後の治癒を狙った治療には応用されにくいのです。
前置きが長くなりました。
こうしてICIは再発・転移乳がん患者さんの延命効果が証明されました。次は手術前後でこの薬剤を使用して、“治癒率”が上がるかどうかです。今までの治療では5割の方が治癒していた、それがICIを使用することによって6割、7割の方が治癒できるのか。その結果が2020年2月に発表されました。
https://www.nejm.org/doi/pdf/10.1056/NEJMoa1910549?articleTools=true
この試験 KEYNOTE-522では、ステージ2あるいは3の比較的進行したトリプルネガティブ乳がん患者さんをランダムに2:1に分け、従来の化学治療(この試験ではパクリタキセル+カルボプラチン → EC あるいはACです)にICIとしてキィトルーダを加えたもの、そしてプラセボを加えた群に分けました。
注意が必要なのは、この試験は手術前の抗がん剤(Neoadjuvant chemotherapyと言います)として行われ、その後に行われる手術でがん細胞が完全に死滅しているかどうか、その割合の高いのはどちらか、という観点で行われました。
手術前化学治療はほぼ半年間で行われます。手術はその後、時を置かずに施行され、摘出された標本はこれもすぐに病理検査されます。つまり半年あれば一人の方のデータが取れます。
術後 治癒したといえるにはトリプルネガティブ乳がんでは最低3年、通常5年間再発がないことが証明されなければならず、治癒した割合を比較する試験は結果が出るのが遅れてしまうのです(これも将来発表されることはわかっています)。
さてその結果です。
ICI投与群では64.8%の方のがんが消失していました。非投与群では51.2%であり、有意(p<0.001)に投与群で成績が良いことが証明されました。副作用は、先日のデータと変わらず、ICIに特徴的な皮膚の変化、そして甲状腺機能異常、副腎機能異常が認められましたが、投与を中止しなければならないレベルの副作用はまれでした。
この試験ではPD-L1の発現条件を加味せずにエントリーが行われたため、PD-L1の発現の強弱で効果が異なるかどうかは結論が出ませんが、発言が強ければ強いほど、効果が期待できることは簡単に予想できることでしょう。
ついに補助化学治療においても、ICIの効果が証明されました。つまり進行したトリプルネガティブ乳がんを治癒に導くことのできる可能性が、ICIによって今後高まることが示されたと言えます。
今まで乳がんは大きく4つに分けられていました。ルミナールA ルミナールB HER2エンリッチ、そしてトリプルネガティブ乳がんです。この分類がそのがん細胞のもつ標的と、その治療によって分けられていたことは皆さんもご存知の通りです。下の図を見てください。
ルミナールBタイプは発言の強弱があってグレーゾーンであり、この4つは実際にはこれほど厳密には分けられない部分もあります。しかしトリプルネガティブ乳がんに関しては、両方とも発現が0であるガン細胞として特徴的です。ホルモン剤も、そしてハーセプチンをはじめとするHER2への標的薬剤も効果が期待できず、抗がん剤に関しても使用してみないと効果はわからないのが原則でした。
しかし以前 姫路赤十字病院のホームページでお話ししたPARP阻害剤(現在リムパーザ®が保険適応になっています)に関しての効く、効かない、そしてそれに加えてICIの効く、効かない、が加わったため、これからはトリプルネガティブ乳がんも4つに分けられることが明らかです。(下の図を参照してください)
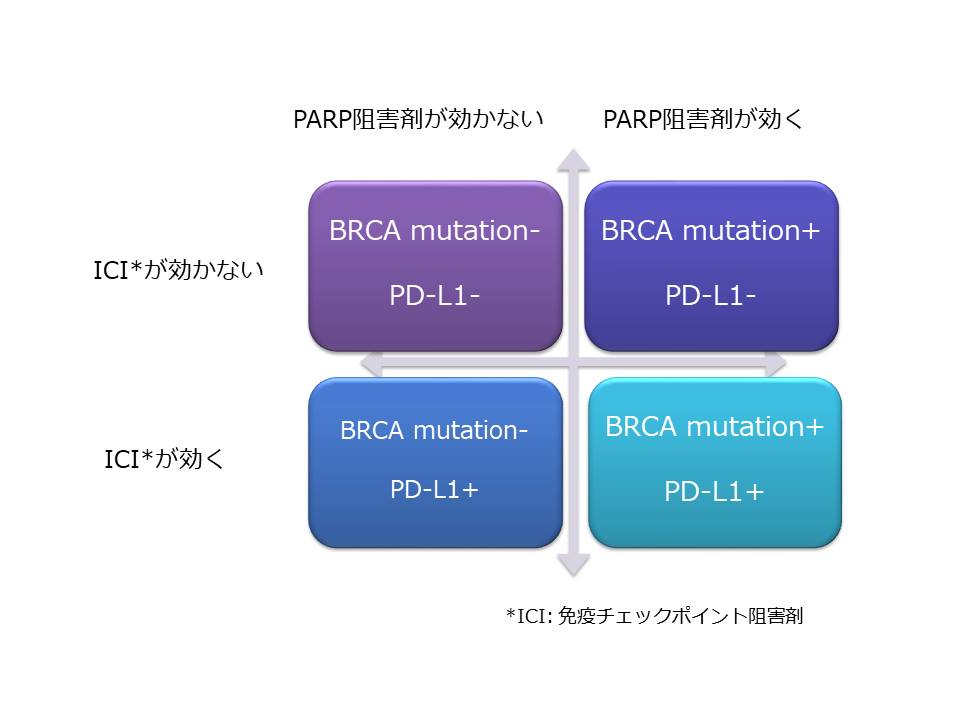
以前書いた6つの分類とは異なる分類ですが、おそらくBRCA mutation+ PD-L1-はBasal like 1タイプのトリプルネガティブ乳がんに、BRCA mutation- PD-L1+はIMタイプのトリプルネガティブ乳がんに相当すると考えられます。そして以前お話ししたとおり、トリプルネガティブ乳がんの6つの分類は、研究室のみで可能な話でしたし、現状はその域を出ていませんが、この4つの分類は今の日本の保険適応の検査でも分類可能です。つまりもはや実践段階なのです。
BRCA mutation- PD-L1-のトリプルネガティブ乳がんのなかのトリプルネガティブ乳がんについても、もちろん研究と治療の開発が進んでいます。6つの分類のうちに薬が揃っていないPI3K阻害剤はすでにたくさんの薬が開発済みで試験が始まっています。
憎きトリプルネガティブ乳がんの包囲網は狭まりつつある、そういえるようになってきています。皆さんの治療に役立つ段階なのです。始まりの終わり、黎明期は終わりました。つかみどころのないトリプルネガティブ乳がん、のイメージは変わりつつあります。これからは実践投入の中でさまざまな喜びと、そして学びの中から更なる課題が出てくるでしょう。
以前 私が勤務していた姫路赤十字病院のホームページでは、乳がんに関していくつか記事を書かせていただいていました。幸いご好評いただき、たくさんのアクセスを頂いた記事もあります。その中でTriple negative(トリプルネガティブ)乳がんの記事は飛びぬけてアクセス数が伸びており、関心の高さを感じさせていただいたとともに、このがんで苦しんでおられる患者さんの多いこともまた実感として感じていました(http://himeji.jrc.or.jp/category/diagnosis/nyusengeka/topics/20170912_3.html)。
その記事の中で“トリプルネガティブ乳がんは一種類ではない”ということを述べました。大きく6つに分けられており、それぞれに対応する治療法もまた開発が進んでいると述べました。6種類のタイプ分けはがんの遺伝子の解析から導き出されたものであり、研究段階であるため、いま病院で治療中の方にはまだまだ応用できるもの、できないものがあります。2021年現在、DNAプロファイリングと呼ばれる手法が、実地臨床にも導入されつつありますが、それでもそれによってきれいに6つに分類できるものではなく、もちろん対応するとされる治療法もそのタイプであれば必ず効いたり、それ以外のタイプには全く効かなかったりするものではありません。トリプルネガティブ乳がんという、特徴のないことが特徴のがんに対して、すこしでも特徴を見つけ、タイプ分けできれば理解が進み、治療の標的を決めやすくなることから、仮にそのように分類された、と考えておいた方がよいでしょう。
さてその記事の中で、IMとされた分類、別名 髄様がん(Medullary breast cancer)について述べました。この種類のトリプルネガティブ乳がんの腫瘍部分を顕微鏡で観察すると、腫瘍浸潤リンパ球(TIL)と呼ばれるがんをやっつけようと集まってくるリンパ球がたくさん観察されます。私たちの体に備わっている免疫細胞が戦ってくれているので、もともとトリプルネガティブ乳がんの中では予後が良いことが知られていました。
ただがんとして、しっかり成立しているのだから、このがん細胞はこうして集まってきているリンパ球を無力化する力を持っていることもわかります。まして転移再発を来してどんどん病状が進んでいればなおさらです。
最近、この働きをつかさどるPD-1、PD-L1と呼ばれるシステムが見つかりました。京都大学特別教授の本庶佑先生が発見したたこの免疫の監視から“逃げる”機能の発見は、のちに様々な方法で“逃がさない”方法を開発することにつながり、がんの治療、特に肺がんの治療方法を画期的、かつ完全に書き換えてしまいました。この功績によって本庶先生は2018年のノーベル賞を受賞されています。

このシステムをわかりやすく描くと上の図のようになります。がん細胞をやっつけようと集まってきたリンパ球に、がん細胞はPD-L1を使って賄賂を渡し、お目こぼしを図る。リンパ球がPD-1でそれを受け取ってしまうと、集まってきても何もしなくなり、攻撃をやめてしまうのです。この賄賂のやり取りの現場は免疫チェックポイントと呼ばれています。免疫チェックポイント阻害剤(ICI)と呼ばれる薬剤はこの現場をブロックしてしまいます。これによってがん細胞をやっつけに来た免疫細胞が本来の役割を取り戻し、攻撃を始めます。これにより、抗がん剤に強い抵抗性を持つがん細胞を破壊することが可能になり、いままで難治とされたがんの治療にも大きな成果が上がっています。
乳がんもその例にもれず、少しずつこのICIが効果を上げるものが見つかってきました。
その一つが先に述べたトリプルネガティブ乳がん、髄様がんであり、またその分類に属さないタイプの乳がんであっても、そのがん細胞が細胞表面にPD-L1を多く表出しているものではICIが効果を発揮することがわかってきました。
2020年米国臨床腫瘍学会(ASCO)で発表され、12月にLansetで論文発表されたKEYNOTE-355は転移性のトリプルネガティブ乳がんに対するICIの効果を証明したものとして大きな話題になりました。(https://www.thelancet.com/action/showPdf?pii=S0140-6736%2820%2932531-9)
この試験ではPembrolizumab(日本名 キイトルーダ)というICIを使用します。
再発・転移を抱えるトリプルネガティブ乳がん患者さんを治療するにあたって、医師が選んだ抗がん剤のみ(プラセボを上乗せ)で治療する群と、抗がん剤に加えてキイトルーダを上乗せする群に分けて、効果(どれくらいの期間進行を抑えることができるのか?)、そして副作用の内容や出現率を比較しました。
まず、PD-L1を強く表出している群、そして弱いけれどもわずかでも表出している群、そしてしていない群に分けます。その上でそれぞれの群をランダムにキイトルーダを使用する群と使用しない群に振り分けたのです。ここでは髄様がんかどうかではありません。がん細胞がPD-L1を出しているかどうか、が問題でした。
下のグラフは、強くPD-L1を表出していたトリプルネガティブ乳がんに対するキイトルーダの上乗せ効果を示した結果です。
このグラフの見方は、50%の患者さんで進行を4.1か月遅らせることに成功した、と読みます。青色の線は常に赤の上にあり、治療期間全体にわたって、キイトルーダを併用した群はしなかった群よりもがんの進行が抑制されました。
治るのではないのか、たかが4か月なのか、とわずかな効果に見えるかもしれませんが、キイトルーダなしで化学治療を行った場合、つまり今まで通りの治療であれば、50%の方は5.6か月で再び進行が始まることが示されています。キイトルーダはそれを9.7か月と倍に伸ばしたことになります。その計算倍率からすれば、今までの治療で1年間有効であった方はそれが2年に延びます。素晴らしい結果だったのです。
一方で副作用はどうでしょう。いままでさまざまな“サプリメント”が“免疫を改善する”、”免疫を増強する”と歌って発売されました。先日もある患者さんと、そういえば水素水も免疫がどうしたこうしたと言われていましたね、と話をしました。免疫の難しいところは、上がったにせよ、下がったにせよ、その機能を測定できない、ところにあります。たしかに白血球が少なくなれば免疫が落ちている可能性がありますが、それも免疫がまったく正常の方でもなんらかの感染がなければ低い数値になっていることはよくあります。逆に感染症を起こして高熱にうなされ、重症になっていれば白血球は上昇していますが、そもそも感染を起こしているのですから、免疫がしっかり働いて、などと感じないはずです。
副作用から見たとき、このICIの恐ろしいところは、がん細胞が免疫から逃げるために使っているPD-L1という分子は、正常細胞も必要な時に使う大切な機能のひとつである、そこを阻害してしまう、ということです。つまりICIが働けば、免疫細胞はがん細胞の攻撃を始めるだけではなく、それを使って免疫から攻撃されないようにしている正常な細胞も攻撃を始めるのです。
キイトルーダを使用したこの試験でのその代表が甲状腺機能低下、あるいは亢進です。橋本病(甲状腺機能低下)、バセドウ病(甲状腺機能亢進)はいずれも免疫の異常によって引き起こされます。これがICIによって引き起こされるのです。それ以外にも、ICIには抗がん剤では見られない特徴的な副作用があることがわかってきています。アトピーに似た皮膚の炎症はよく見られる合併症です。副腎機能異常、心筋炎といった重篤な副作用も報告されています。
ICIを使って治療を行っている医師の間では、免疫のお薬だから、効果は高く、副作用は軽い、だから抗がん剤よりも気楽に使える、と考えるのは早計だということがもうわかっています。ただいままで抗がん剤で治療してきても効果が今一つ得られなかったがん患者さんには、選択肢が確実に増え、朗報であることは間違いありません。
長くなりましたので、次回と2回に分けて、トリプルネガティブ乳がんと免疫チェックポイント阻害剤について、さらに解説していきます。
4月27日 国立がん研究センターが、2008年にがんと診断された人の10年後の生存率を発表しました。といってもこれまでも発表はなされてきたので、最新のデータに更新されたというのが本当です。各新聞報道も大きく扱ったようです。
紙面では、” 胃や大腸など、がん全体で、10年後の生存率は59・4%” と発表されています。専門的ながん医療を提供している全国240施設の約24万症例を対象にした調査で、これまでに発表された10年生存率の統計で、最も大規模なものです。がんは不治の病とされていましたが、実際には半分以上の方が生還されているということは驚きをもって迎えられたと思います。
ちょっとひっかかったことです。私が読んだ新聞数紙では、”胃がんや大腸がんなど” と書かれていることが多かったのですが、皆さんの新聞ではどうですか?すでに女性は大腸がん、肺がんの順で亡くなる方は多いので、すでに4位に落ちた胃がんをトップに述べるのは“古いな”という印象です。いまでも胃がんががんの象徴なのかな、と推測できます。マスコミの方々の頭脳の刷新をしてもらいたいものです。
がんの種類別では、10年生存率が最も高いのは前立腺がんで、98・7%。女性の乳がん(87・5%)、子宮内膜がん(83・0%)、子宮頸(けい)がん(70・7%)、大腸がん(67・2%)と続きました。私の就任のあいさつでも書かせていただいたとおり、乳がんの生存率の高さが際立ちます。(前立腺がんだけは統計の処理の違いで、少しおかしなデータになっています。)
ただここまでは新聞でも描かれている記事ですので、私は別の視線から記事を深堀してみたいと思います。毎日新聞のサイトには部位別がんの5年、10年生存率のグラフと数値が出されていました(https://mainichi.jp/articles/20210427/k00/00m/040/039000c)。だれでも見られるので参考にしてみてください。
例えば大腸がんではそれぞれ72.6%そして67.2%です。100からマイナスしてみます。すると大腸がんでは最初の5年で27.4%なくなり、その後の5年間でさらに5.4%なくなる計算になります。
胃がんは72.1%、66.0%ですので、27.9%、6.1%となります。子宮内膜がんは84.4%、83.0%ですから15.6%、1.4%、子宮頸がんは75.2%、70.7%なので24.8%、4.5%になります。こうして5年間で亡くなる方、その後の5年間で亡くなる方を計算して、グラフ化してみました。
下、左のグラフがそうです。そのままではわかりにくいので右に計算しなおしました。右のグラフでは最初の5年間で亡くなる方を100とし、そこからの5年間で何人が亡くなるか、揃えてみました。乳腺で赤が飛びぬけて高いと感じませんか?
これが乳がんの特徴です。子宮内膜がんやすい臓がんはその逆で低い。つまり最初の5年間を生き抜けば、その後はずいぶん安心と言えます。ところが乳腺では60%相当の方が次の5年で再発されるため、油断できません。
乳がんの患者さんでホルモンレセプター陽性乳癌として、毎日ホルモン剤を飲まれている方がおられます。2008年の段階ではこれらの方のほとんどがホルモン剤を5年で終了していました。現在では患者さんによりますが延長され、10年、15年継続して飲まれている方もおられます。さて乳癌の患者さんの中でホルモン剤を飲まれている方の割合はどれくらいかご存知ですか?60から70%なのです。それらの人が5年間無事に過ごされて、その時点でホルモン剤を完了している。もしその時点ではがん細胞は消えておらず、ホルモン剤によって抑え込まれていただけだったとしたら…
もちろんホルモン剤を5年で終了したすべての方がその後の5年間で再発するのではないので、60%で一致しているのはただの偶然です。ただ相当に不気味であることは事実でしょう。実際、乳がんならでは特徴である、5年の経過だけでは安心できない、その原因にホルモン剤の影響があることは間違いない事実です。
このことを解説した記事を4月23日に書きました(https://www.nishihara-breast.com/blog/2021/04/4/)。ここでもう一度参考にしていただければ、さらに理解が深まると思います。ホルモン剤を飲まれている乳がん術後の方はここでもう一度、深堀して考えていただければと思います。
Q: 乳がん患者はCOVID-19のワクチン接種は可能ですか?
最近、外来で経過観察させていただいている患者さんによく聞かれる質問に答えさせていただきます。ただご存じの通り、日本ではまだ数%の方しかワクチン接種を受けておらず、日本人のデータそのものが乏しい状況です。まして乳がん患者さんに摂取して何が起こるのかは世界的に見ても研究がまだ進んでいません。そこでここでは接種の進んだ米国のデータから参照しました。ここで述べるデータは米国の国家機関から国民に向けて行われた発表内容ですので、信頼できるデータです。www.breastcancer.org/about_us/press_room/news/coronavirus
A: 答えはYESです。COVID-19ワクチンは緊急使用下において認可が下りていますが、現在乳がんにて治療中、そして過去に乳がんに罹患した経験のある方でも安全かつ有効であると考えられています。米国疾病予防管理センター、米国総合がんセンターネットワーク、そしてその他専門医による団体は、担癌患者さんにむしろ優先的にワクチン接種を受けるよう勧めています。もちろん各個人の状況は異なりますので、実際の摂取に当たってはまず主治医と相談することを勧めています。
2020年12月、アメリカ食品医薬品局はファイザー社、モデナ社製のCOVID-19ワクチンの緊急使用を認可しました。ジョンソンエンドジョンソン社製のワクチンは2021年2月に許可しました。他国で使用されているワクチン、そして新しく開発も進んでおり、順次認可していきます。
2021年4月にアメリカ食品医薬品局、米国疾病予防管理センターはジョンソンエンドジョンソン社製ワクチン使用について、“多くの検討事項の発生”を受けて、一時停止処分を決定しました。これによって医療関係者に、ジョンソンエンドジョンソン社製ワクチンを使用して血栓症を発症した6名の患者さんを含めて、これらを調査し、対応する時間的猶予を設けています。(最近解除されたようです。ただ血栓症についてはまだ完全には解明されておらず、注意喚起が添付されているようです。2021年4月25日注 ファイザー社、アストラゼネカ製のワクチンでも血栓症の報告は0ではないようです。すでにジョンソンエンドジョンソン社のワクチン特有の副作用ではないのでは、との報告も出ているようです。2021年6月注)
ワクチンは活性のあるウィルスを含んでいるわけではありません、ですので、がんの治療中などの理由で治療免疫が弱った方に使用することに問題があるわけではありません。アメリカ食品医薬品局はこれらのワクチンが安全で、かつCOVID-19の感染、重症化、そして死亡から身を守るのに有効であることを確信しています。ただワクチン接種しても、その効果がいつまで続くのか、そして接種後にウィルスにさらされた時、自分は症状のないまま、それをそのままほかの人に感染させないのか、まだわかっていません。ですので、マスクを着用し、距離をたもつことをワクチン接種のあとも継続するよう勧めています。
専門家はいまがんの治療中の方、がんの既往歴のある方、いずれもCOVID-19のワクチンを受けられることを勧めています。ただそれぞれの方で事情は異なりますので、実際に接種の際には、その判断が正しいかどうか、主治医に相談してから受けるようにしましょう。
にしはら乳腺クリニック院長 渡辺直樹
ご予約専用ダイヤル
079-283-6103