2024.10.18
(IUS:子宮内避妊システム)は、子宮内に装着することで避妊の効果を得る避妊具です。一般に、「避妊リング」とも呼ばれています。
避妊リングには種類があり、銅の働きで着床を防ぐものと、レボノルゲストレルという黄体ホルモンを継続的に放出し、子宮内膜を薄い状態で維持することで、受精卵の着床を防ぐものがあります。ご自身の使用されているIUSの種類は、薬剤添付情報や、お薬手帳で確認ください。
黄体ホルモンを継続的に放出し、子宮内膜を薄い状態で維持するIUS(これ以降LNG-IUSと略します) は、このメカニズムによって月経困難症や過多月経の改善にも有効性が認められています。2014年には、子宮内膜症・子宮筋腫・子宮腺筋症等に伴う月経困難症と過多月経に対する治療として保険適用となっています。そしてこれらの効果が最長で5年ほど継続します。
低用量ピルが体に合わなくて、これをつかわれておられる女性も多いと思います。

定期的に引用しなければならない飲み薬と違い、忘れることがなく、便利なので、このLNG-IUSの使用は近年増加しています。30歳以上のデンマークの閉経前女性の間で好まれるホルモン避妊法なのだそうです。しかし、LNG-IUSの使用が乳がんリスクと関連しているかどうかは不明です。
私の日常の外来では、乳腺が張って痛む、と訴えて来院される方が大変多い。そうした方で問診をしてみるとこのLNG-IUSを使用されておられる方が珍しくありません。LNG-IUSの使用開始とともに乳腺の症状が出たりしているのでなんらかの関係はあるのだろうな、とは思っていましたが、衣料品医薬品情報、いわゆる添付文章(薬を購入すると入っている、詳しい情報が記載している細長い白い紙)を読んでも乳がんとの関連を示唆する部分はいままでありませんでした。
そこで私は乳腺に痛みがあっても、乳がんと直接関係している報告はないので安心してください、と説明してきました。ただ最近出た論文によると、それはいままできちんと調査がされていなかっただけのようです。リナ・スタインルード・モルヒ博士らはデンマークでLNG-IUSの継続使用による乳がんリスクを評価しました。(Mørch LS, Meaidi A, Corn G, Hargreave M, Wessel Skovlund C: Breast Cancer in Users of Levonorgestrel-Releasing Intrauterine Systems. JAMA 2024.)
方法としてはデンマーク全国登録簿を使用して、2000年から2019年に15歳から49歳までの初めてLNG-IUS(用量52 mg、19.5 mg、13.5 mg)を開始したすべての人を特定し、開始日(インデックス日)にホルモン避妊薬を使用していなかった人と出生年を1:1で一致させました。
参加者は、インデックス日から後に発生した乳がんの診断、その他のがんの診断、妊娠、閉経後ホルモン療法の開始、移住や死亡について、追跡調査されました。LNG-IUSには種類がありますが、使用されている95%が6年間有効とされるものでした。
Cox比例ハザードモデルという統計の方法を用いて、年齢、暦期間、以前のホルモン避妊期間、排卵誘発剤、出産回数、初回出産年齢、多嚢胞性卵巣症候群、子宮内膜症、およびインデックス日時点の教育水準を調整したLNG-IUSの継続使用と乳がんとの関連性を分析しています。
この研究では合計78,595人の新規LNG-IUS使用者と、78,595人のホルモン避妊薬非使用者が特定されました。
この女性たちの平均6.8年の追跡期間中に、1,617人の参加者が乳がんと診断されました。そのうち720人がLNG-IUS使用者、897人が非使用者でした。参加者の平均(SD)年齢は38(7.7)歳でした。これだけを見るとLNG-IUS使用者の方が発生率が低く見えるのですが、これは調査上そう見えるだけで実際にはLNG-IUS使用者の方が乳がん発生率が高いという結果になりました。
ホルモン避妊薬を使用しない場合と比較した、LNG-IUS 使用時の乳がんのハザード比(HR)は 1.4(95% 信頼区間 1.2-1.5)でした。つまり1.4倍乳がんの罹患リスクがある、ということになりました。
使用期間が 0~5 年、5 年以上 10 年、10 年以上 15 年の場合、対応する不使用期間と比較した HR はそれぞれ 1.3(95% 信頼区間 1.1-1.5)、1.4(95% 信頼区間 1.1-1.7)、1.8(95% 信頼区間 1.2-2.6)でした。
このデンマーク全国調査では、LNG-IUS の使用と、使用しない女性と比較して 15 歳から 49 歳の女性の乳がんリスク増加との間に関連性があることが判明しました。若い女性の乳がんの絶対リスクは低いものの、この調査では 10,000 人の女性のうち 14 人の過剰リスクが判明しました。リスクは使用期間とともに増加しませんでした。
乳がんリスクのある年齢の女性における LNG-IUS の使用が増加していること、また長期使用の可能性もあることを考慮すると、利点とリスクについての議論には乳がんリスクに関する情報も添えるべきです、とモルヒ先生は述べています。ただLNG-IUS の短期使用による HR は、避妊薬のリスクと同等でした(使用によって乳がんの罹患リスクが1.2倍になる)。
まとめ
この論文一つでLNG-IUS使用に、乳がんリスクがあると結論付けるのは早計ですが、いままで十分な調査がなされていなかったことを考えれば、無視することもできません。少なくとも注意喚起、つまり使用するのであれば乳がん検診の受診や、定期的な自己チェックを指導することは必要であるように思います。
もし皆さんの中に、使用されておられる方がおられましたら、ぜひ乳がんの定期検診をご検討ください。
2024.10.09
以前もこの話題に触れました。乳がんはなぜ増えているのか。その理由は少子化です。皆さんが思われている食生活の変化、炭水化物からタンパク質へ、が影響しているかは実際には証明されていません。
授乳経験の現象、これが乳がんの発生をもたらす、この理由について京都大学の研究結果をもとに説明しています。よかったらもう一度読んでみてください。
皆さんの周囲でも実感的に乳がんの患者さんは増えていると思います。実際どれくらい増えているのか。乳がんの罹患率、たとえば10万人の女性の方で何人がその生涯で乳がんに罹患するか、その率で見てみると、この半世紀で20年ごとに倍になっています。つまり一世代、母から娘の代に変われば倍になる、ということになります。ウソではありません。
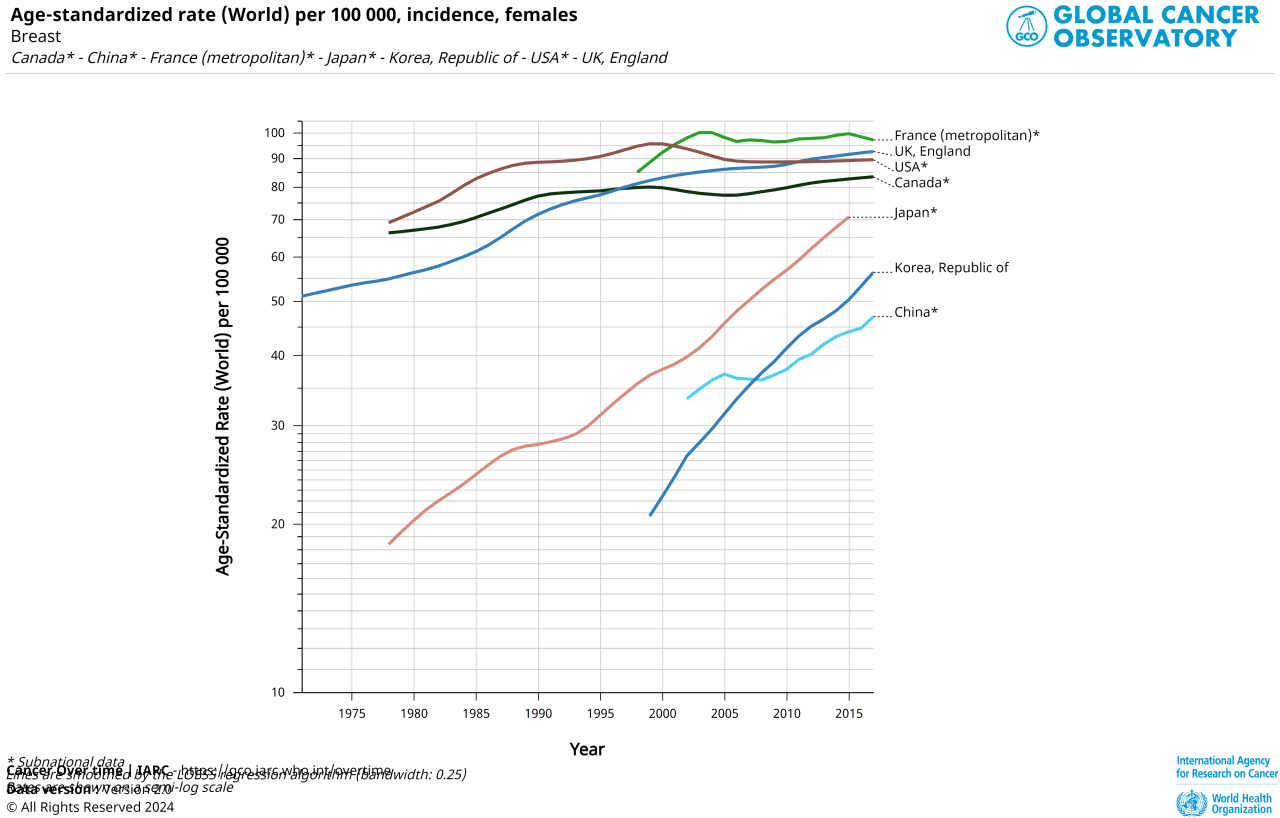
上記はWHOのデータから作ったグラフです。
これでわかるとおり、米国やヨーロッパ諸国に比べ、わが国(Japan オレンジ)だけではなく、韓国、中国の乳がん罹患率の急激な増加が見て取れます。
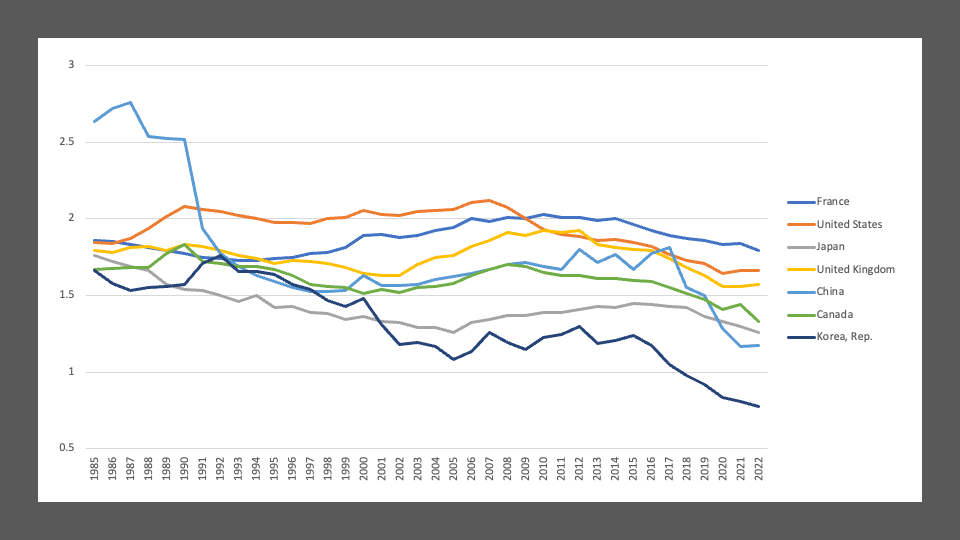
そして次に示すのがおなじくWHOのデータベースから作成した出生率のグラフです。米国やヨーロッパの国々と比較して、アジアでは出生率の低下が急激です。特に中国では一人っ子政策の影響で突然低下しました。そのまま横ばいですが、回復はしていません。そしてそのつもりで乳がん罹患率のグラフを見ると、少子化こそ乳癌増加の原因である。授乳経験の現象が原因である、ということが直感的に理解できます。
少しややこしいことを言いますが、授乳経験の過多には栄養状態も加味して考える必要があります。なんだ、結局食生活が影響するのか、とはなりますが、授乳は母体が栄養状態が良好でなければできません。つまり栄養状態が良好なのに、子供を産まない、授乳しないという矛盾した行動が、結果として乳がんを増やします。栄養状態が悪い国では少子化の影響はあまり出ません。
乳がんはなぜ増えているのか。その理由は明らかに少子化です。
そして最近それの根拠となる論文がまた出ました。
Jessica O’Driscoll先生らによる「Reproductive factors and mammographic density within the International Consortium of Mammographic Density: A cross-sectional study」です。
彼らは出産数・初産年齢とマンモグラフィ濃度の関連を22ヵ国1万1千人のデータから証明して見せたのです。ちなみにマンモグラフィにおける乳腺濃度が乳がんのリスクと関連する話はこのブログでも何度も触れてきました。よければまずこの記事を読んでみてください。
一部 表を抜粋して示しました。
|
|---|
乳腺濃度は子供を産んでおられない20代から30代前半の女性では高くて当たり前なので、この記事の中では65歳以上の女性について、乳腺濃度と乳がんリスクを比較しながら述べています。
表でも示した通り、濃度の高い女性では脂肪性乳腺の方と比較して乳がん発生のリスクは2倍にもなります。
授乳経験が少ない → 乳腺の濃度が高い → (閉経しても)乳腺が多い(ままである) → 乳がんが発生する母地が多い → 乳がんのリスクは高い
こうした理屈です。
これも以前述べましたが、年齢や肥満指数(BMI)、つまり栄養状態は、マンモグラフィにおける乳腺濃度に強く影響すると同時に、乳がん発症リスクとも関連することはこのように確立されています。
ただびっくりなのですが、出産数、初産年齢、授乳歴と乳腺濃度との関連は明らかになってはいませんでした。
彼らは、乳がんではない35~85歳の、11,755人の女性の乳腺の濃度を記載したデータをプールしている22ヵ国27研究を集めて共同研究を行うために、40の国・民族の集団を網羅しました。(これだけで膨大な手間と時間がかかるでしょう。)
彼らは統計学的な手法を用いて、乳腺の濃度と、出産数、初産年齢、授乳歴の有無、生涯授乳期間との線関連を検討しました。最終的に解析対象となった1万988人の女性のうち、90.1%(9,895人)が出産経験があり、うち13%(1,286人)が5回以上経験していました。初産時の平均年齢は24.3歳でした。
結果です
出産数(1回増加当たり)は、乳腺の濃度が高い女性の比率、そして乳腺の濃度が高い面積と逆相関していました。つまり出産経験のある女性では濃度が下がっている確率が高く、そして濃度の高い面積も減少します。この傾向は少なくとも出産が9回まで明らかでした。
初産年齢(5歳増加当たり)は、乳腺の濃度が高い女性の比率、そして乳腺の濃度が高い面積と正の相関していました。つまり若く出産すればするほど、濃度が下がっている確率が高く、そして濃度の高い面積も減少します。そして同時に濃度が低い面積が増加していました。
出産経験のある女性においては、授乳歴の有無や生涯授乳期間は乳腺濃度と関連は認められませんでした。これは私が今まで書いてきた記事と矛盾しています。私は出産されても授乳をしなければ乳腺濃度は下がらないと考えてきましたが、そうではないようで、出産することそのもので濃度は下がるようです。
今回の結果からは
授乳経験が少ない → 乳腺の濃度が高い → (閉経しても)乳腺が多い(ままである) → 乳がんが発生する母地が多い → 乳がんのリスクは高い
となるのではなくて、単純に
出産経験が少ない → 乳腺の濃度が高い → (閉経しても)乳腺が多い(ままである) → 乳がんが発生する母地が多い → 乳がんのリスクは高い
となることが示されました。論文を見ると、授乳期間の長さは乳腺の濃度と関係しているように見えるのですが有意ではなかったようです(統計学的にはそうは言えなかった)。
ただどちらにしても少子化こそ乳がんの罹患率の増加につながる原因なのだ、ということは揺るぎません。そして我が国では少子化は止まるどころか悪化し、そしてすでに最新のデータでは米国やヨーロッパ諸国を抜いています。それは裏返しに言えばいずれ乳がんの罹患率は米国やヨーロッパを追い抜くということになります。おそらく現在の9人に1人から、5−6人に1人まで増えるのではないでしょうか。
恐ろしいことです。
2024.09.02
私はきちんと2年おきにマンモグラフィ検診を受けている、だから絶対大丈夫・・・
本当にそうでしょうか?
最近も芸能人の方が毎年ドックをしていたのに、乳がんが発見されたら進行がんだったと公表されています。しかしこの内容はどこかで何度か聞いた話です。もはや驚かない方も多いのではないでしょうか。
雨の乳がん学会・・・その2で”中間期がん”について述べました。(英文ではInterval cancerと言います。日本語訳は私なので、正式には違う日本語かもしれません(汗))
中間期がんとは、検診を定期的に受けておられる方が、それでも検診ではなく、ご自分で腫瘤に気づいてしまうなど、検診以外で乳がんを発見してしまう場合、これを中間期乳がんと言います。
そうした場合には、その前の検診でがんを見落としたのではないか、とも考えられますが、短期間で急激に大きくなるがんの存在もあり得ます。それであったと反証する方法がないため、誰が見ても前回のマンモグラフィで異常を発見できなければ、真の中間期がんとして扱われています。
そしてその中間期がんが、残念ながら早期がんではなく、進行して見つかった場合、「私は2年おきにマンモグラフィ検診を受けているので大丈夫」・・・ではなかった!となるわけです。
大事なことなので繰り返しになりますが、米国予防サービス特別委員会 (USPSTF) による乳がんスクリーニングガイドラインでは、すべての女性が40歳から隔年で、つまり2年おきに乳がんの検査を受けることを推奨しています。
これは米国予防サービス特別委員会 (USPSTF) による乳がんスクリーニングガイドラインはMonticcioloをはじめとする研究者らによる、がん介入・監視モデリングネットワーク(CISNET)の2023年乳がんスクリーニング結果に基づいて定められました。研究者らは乳がん検診の利点とリスクを以下の4つの異なるシナリオで比較しました。
1、50~74歳の女性を対象とした2年に1回の検診
2、40歳から74歳の女性を対象とした2年に1回の検診
3、40歳から74歳の女性を対象とした年1回の検診
4、40歳から79歳の女性を対象とした年1回の検診
結論として、Monticcioloは、40歳から79歳の女性を対象にデジタルマンモグラフィまたはトモシンセシスによる年1回のスクリーニング(つまりシナリオ4)により、検診をうけない群と比較して、死亡率が41.7%減少することを発見しました。一方、シナリオ1では25.4%減少し、シナリオ2では30.0%減少しました。それはとても素晴らしいことではあります。しかし、検診の頻度を2年に1回から1年に1回にしても乳がんで死亡する確率を10%下げるだけだったのです。
Monticciolo DL, Hendrick RE, Helvie MA: Outcomes of Breast Cancer Screening Strategies Based on Cancer Intervention and Surveillance Modeling Network Estimates. Radiology 2024, 310(2).
対策型乳がん検診(市町村が行う検診)は乳がんによる死亡を抑制する目的で行われます。乳がんにならないためではありません。(ならない方法は見つかっていませんし)
私のクリニックがある医療圏では毎年140名の方が亡くなっていると言いました。2年に1回の検診を1年に1回の検診に倍に増やしても、140名が120名になるだけなのです。それが小さいとは言いません。ただ医療コストは毎年にすることで単純に倍になるので、それに見合わないとは言えると思います。

Orsiniらの最新の研究では、中間期がんは全発見乳がん症例の28.9%にのぼり、その腫瘍の平均サイズは18mmでした。ちなみに20mmをこえると進行がんです。だから平均しても早期発見できています。
Orsini L, Czene K, Humphreys K: Random effects models of tumour growth for investigating interval breast cancer. Statistics in Medicine 2024.
しかし私が経験した患者さんで、過去3年以内に検診歴のない自己発見乳がん症例1541例における腫瘍サイズは触診では24.0mm、病理切片上では23.4mmでした。進行がんです。
同じ中間がんでも、検診を定期的に受けられている方では不規則に受けておられる方よりもサイズを小さく見つける傾向があります。乳がんは検診で見つけることだけが重要なのではなく、検診を定期で受けておられる方は乳がんへの関心が高く、そういう方は日常注意しているから早期で発見できている可能性があります。
しかし検診を受けているから私は大丈夫、安心だ、と決めつけてしまえばその効果は失われ、むしろ逆効果になります。中間期がんに無関心になるからです。検診と検診の間も乳がんの発生に注意を払い、日常気を付けるからいいのであって、むしろ検診をうけているからと、普段気にもしなくなってしまえばそれは油断そのものであって、安心とは違いますよね。

そしてこの話題、本当にしつこいですが、最新の論文で、乳がん検診受診の間隔と、末期進行乳がんでの発見、そして乳がん死の関連について、発表がありました。
Zuley ML, Bandos AI, Duffy SW, Logue D, Bhargava R, McAuliffe PF, Brufsky AM, Nishikawa RM: Breast Cancer Screening Interval: Effect on Rate of Late-Stage Disease at Diagnosis and Overall Survival. Journal of Clinical Oncology 2024.
USPSTFは 最終的に2年おきの検診がベストとしましたが、乳がんを研究している学者、臨床医はやはり毎年だ、と反論しているのです。それが論文としてたくさん出てきているのでしょう。
Zuleyらが報告した観察分析によると、マンモグラフィ検査を年に1回していると、40歳以上の患者の臨床的および人口統計学的サブグループ全体で末期進行乳がん(Stage IIB以上で見つかることをこう呼んでいます。リンパ節にすでに転移をきたし、他の臓器に転移をきたしている可能性の高いがんです。)のリスクが低下し、乳がん死を減らして生存率の延長をもたらします。
たしかに「USPSTFが提案しているスクリーニングガイドラインは、がんを発見できる利点と、偽陽性に関連する潜在的な害およびコストとのバランスをとる必要があり、そして隔年での推奨になりました」と、インディアナポリスのインディアナ大学メルビン・アンド・ブレン・サイモン総合がんセンター女性クリニックの上級副編集長、キャシー・D・ミラー医学博士(FASCO)は声明で述べました。
しかし「Zuleyらのこの研究は、USPSTFが用いたモデリング研究の結果を補完して、ほとんどの女性に対する隔年ではなく、年1回のスクリーニングをすることを支持するものです。」
研究者らは、2004年から2019年の間に診断前マンモグラフィ検査を受けた40歳以上の乳がん患者8,145人を特定しました。この集団のうち、早期段階(ステージ 1~2A)および後期段階(ステージ2B~4)は、それぞれ2,065人(25%)および1,121人(14%)でした。
そしてZulkeyらは、Monticcioloらと同様に、検診を受けておられた間隔を 4 つのカテゴリに分類しました。
1 ベースライン(症例数 が 2,307で全体の28%):診断前のスクリーニングエピソード1回(いままで1回だけだが検診を受けたことがある方)
2 年次(3,369例 41%):直近2回の検査の間隔は最大15か月(毎年検診群)
3 2年ごと(1,340例 16%):直近2回の検査の間隔が15か月以上27か月以内(2年おき検診群)
4 断続的(1,129例 14%):直近2回の検査の間隔が27か月以上。(ときどき検診される群)
末期進行乳がんの診断率は、毎年検診群、2年おき検診群、ときどき検診群で、それぞれ9%、14%、19%でした(有意差あり P <.001)。検査間隔が長くなるにつれて末期進行がんの比率は増加します。そしてこの増加傾向は、年齢、人種、閉経状況に関係ありませんでした。
2年おき検診群や(これはわかる人のみ参考にしてください。単変量ハザード比[HR] = 1.42、95%信頼区間[CI] = 1.11〜1.82、多変量HR[年齢、人種、閉経状況、乳がんの第一度近親者で調整済み] = 1.48)
ときどき検診群では(これはわかる人のみ参考にしてください。単変量HR = 2.69、95% CI = 2.11〜3.43、多変量HR = 2.04)
毎年検診群と比較して、全生存率が有意に低い(P < .001)ことがわかりました。
しかし私はこの論文をもう少し読み込んでみました。早期乳がん つまりステージ 1で見つかる割合はどうだったのでしょうか。
毎年受けられている方では全体の52%がステージ 1でした。半分は早期で見つけられていません。
2年おきだと 47%です。ときどき検診される方では46%でした。
これおどろきませんか?思い付きでときどき検診していても、2年おきにであってもきちんと検診していても、ステージ 1で早期発見できる確率は変わらないのです。
ではステージ 4の末期の方はどうなのか?
毎年受けられている方では全体の1%がステージ 4でした。二年おきだと1%です。ときどき検診される方では2%でした。
毎年検診していて、乳がんが発見されたら100人に一人はすでに末期なのです。そしてそれはときどき検診しているかた、2年おきに検診している方でもほとんど変わらない。これではUSPSTFが言うとおり、2年に1回の検診で十分、さらに推奨レベルもBどまり、でも仕方ないように見えませんか?

ここまで述べてきて、私自身は、検診が毎年なのか、2年おきなのか、その間隔よりも、乳がん検診を定期的に受けることによって、自分自身でも乳がんに関心を持ち、気を付けるようになることによる死亡抑制効果の方が大きいのではないか、と考えています。毎年にしてもそれほど早期発見率は上がらず、そして末期での発見率も大きくは下がらないからです。
歯医者さんに診てもらう機会が、年に1回なのか、2年に1回なのかよりも、所詮は年に何回か、のこと。そんなことよりもそのことで気持ちを改めて歯磨きをきちんとすることの方が虫歯予防には有効なのではないか、と考えます。
ここで誤解しないでいただきたいのは、検診を受けても無駄だと申しているのではありません。
検診をうけているから大丈夫と決めつけてしまい、日常に自己チェックをしないなど、まったく気にしなくなってしまうようであるなら、検診をうけていることはむしろ逆効果になり、検診が持つ大事な良い効果がなくなってしまうのではないでしょうか。
だからその意味において、乳がん検診をきちんとうけていても大丈夫ではない、とあえて提案させていただきたいのです。自己チェックと検診は車の両輪であり、歯磨きと歯医者による定期健診同様の関係と同じである、いやむしろ普段の自己チェックこそより重要である、と考えていただきたい、そう思っています。
2024.08.04
化学治療、特にタキサン系と呼ばれるパクリタキセル、ドセタキセルを投与された患者さんは、治療終了後も長く残る副作用としての末梢神経障害、指先がしびれる、足の裏にずっと違和感がある、絨毯の上を歩いているような感じ、に苦しめられています。
化学治療は終了していて、髪の毛も生えそろい、爪は元に戻った。食欲もある。でもそれだけが治らない。末梢神経障害は年単位で残るため、気にされているかたも非常に多い合併症です。
しかも数年経過したら消えるのならまだ我慢できるでしょうが、医師として、この後遺症はほぼ生涯にわたって残る、ことを覚悟してください、と言わざるを得ないため、なおさら患者さんを苦しめることになります。この後遺症は年齢に依存性があり、若い方ではもともと出現しないことも多く、ある程度あっても化学療法を終了したら速やかに改善していきます。逆に50歳以上の方では症状も強く出て、さらに出た限りはほぼ生涯継続されていることが多いこともわかっています。
私は以前から、自分の経験的によく運動される方ほど、症状が出にくく、また改善もしやすいことを知っていました。その方面から研究したことはないのですが、神経障害に対するさまざまなお薬、漢方薬、有効と言われる様々なお薬を投与してもいままで有効だ、と感じたことは正直ありません。ただ運動をよくされる方では出てこないし、治る。そして若い方はもともと少ないことから、この厄介な後遺症には運動がもっとも有効だ、と思ってきました。私の患者さんであれば、また運動か、先生はいつもそれ、と言われる方も多いはずです。覚えておられるでしょう。
そもそもその方が納得できる理論づけができるからです。
もともと体を構成する細胞の中で神経細胞はもっとも代謝、古いものを捨て、新しいものに作り替える、その働きが遅く、また起こらない細胞になります。逆は粘膜細胞で、胃や腸の粘膜細胞などは数日単位で入れ替わっています。
これは当たり前で、もしそんなに頻回に代謝されていたら記憶もなにも飛んでしまいます。
また神経細胞は体の中でもっとも”長い”細胞でもあります。すべての神経は脳につながり、信号を送り、受け取っているのですが、脳から足先まで、細胞から細胞のバトンタッチはあるにせよ、ほぼ3-4個の細胞の信号の受け渡しで普段の生活は成り立っています。細胞そのものの大きさを考えるなら、むしろ神経細胞は小さな砂、というよりも細い糸、の方が近い形をしています。
そのため、抗がん剤のような化学物質の影響を受けやすく、細胞を破壊こそしなくても、沈着する範囲もかなり大きいものになるはずです。それが代謝されないのですから、症状は消えない、残り続けるでしょう。
では若い方、運動する方ではなぜ後遺症が出にくいのか、それは代謝が盛んだから、です。
逆に言えば、後遺症を無くするためには神経を”壊し”て、むりやり代謝をさせればいいということになります。もちろんそれは簡単ではありません。脳梗塞や、脳出血、脊髄損傷などで神経が破壊された方が何年もかかってリハビリをして機能を取り戻されるように、もともとそんなことはできない、といってもいいかもしれない。けれどもそれしか方法がないのなら、少しずつでも努力するしかない、私はそう考えてきました。それに適度の、この場合は筋肉痛レベルの代謝を起こすレベルの運動にはなりますが、運動そのものには、末梢神経障害が残念ながら消えなかったとしても、頑張って悪いことはありませんから。
そして今回の本題 バーゼル大学(スイス)のFiona StreckmannらによってJAMA Internal Medicineという雑誌に、化学療法を受ける患者の多くが発症する化学療法誘発性末梢神経障害(以降CIPN)の回避には運動が有効である可能性が、新たな研究で示唆されたことが掲載されました。
Streckmann F, Elter T, Lehmann HC, Baurecht H, Nazarenus T, Oschwald V, Koliamitra C, Otten S, Draube A, Heinen P et al: Preventive Effect of Neuromuscular Training on Chemotherapy-Induced Neuropathy: A Randomized Clinical Trial. JAMA Intern Med 2024.
この研究では、運動をしなかった患者でCIPNを発症した者は、運動をした患者の約2倍に上ることが示されたそうです。私の話と少し違うのは、末梢神経障害の治療、ではなく、発症そのものを”抑制する”ということが分かった、ということになります。

研究によれば、化学療法を受ける患者の70〜90%は、末梢神経障害として、痛みやバランス感覚の障害、しびれ、熱感、ピリピリ感やチクチク感などのCIPNの症状を訴え、半数の患者は、がんの治療後もこのような症状が持続するとされます。
今回の研究では、オキサリプラチン、またはビンカアルカロイド系抗悪性腫瘍薬による化学療法を受ける158人のがん患者(平均年齢49.1歳、男性58.9%)を対象にランダム化比較試験を実施しました。
この研究では、感覚運動トレーニング(sensorimotor training;SMT)と全身振動刺激(whole-body vibration;WBV)トレーニングがCIPNの発症や症状の低減に有効であるかどうかが検討されました。
対象者は、
SMTを受ける群(55人)、
WBVトレーニングを受ける群(53人)
運動は行わずに通常のケアのみを受ける群(対照群、50人)にランダムに割り付けられました。
介入群(SMT群とWBV群)は、1回当たり15〜30分間のトレーニングセッションを週に2回、化学療法が終了するまで受けました。
結果ですが、CIPNの発症率はこうしたトレーニングを行わなかった対照群で70.6%であったのに対し、SMT群では30.0%、WBVトレーニング群では41.2%であり、対照群に比べて介入群では有意に低いことが明らかになりました。
また、2種類の介入のうち、より効果が高かったのはSMTで、SMT群では対照群よりも、開眼/閉眼で両足立ちでのバランスコントロール、片足立ち、振動感覚、触覚、下肢の筋力の改善、および痛みと熱感の軽減の程度が大きく、化学療法の投与量削減を受けた患者が少なく、その結果としては当然ですが死亡率も低いという結果になりました。
Streckmann氏は、「CIPNが発生してしまうと、患者に必要な化学療法サイクルが計画通りに実行できなかったり、化学療法に含まれる薬剤の投与量の削減を求められたり、さらには治療の中止など、臨床治療に直接的な影響を与えます」と話します。これは当然 化学治療のパフォーマンスに影響し、しいては乳がんの予後を悪くする結果につながります。
同氏によると、現時点ではCIPNの予防や回復に有効な薬剤は見つかっていません、とも述べています。これについては私も同じ意見を持っており、今でも苦しんでおられる方が多いということはそういうことだと思います。
しかしおそらく日本でも同じですが、米国の医師は毎年、CIPNの治療に患者1人当たり推定1万7,000ドル(1ドル160円換算で272万円)を費やしているといいます。彼は、「これに対し、運動は効果的である上に安価だ」と述べました。これも全く同じ意見です。
以前、米国がん予防タスクフォースが、毎年ではなく、隔年での乳がん検診を推奨した、という話をした際に、確かに乳がん死の抑制は得られるが、それに伴って無駄な検査も増え、医療費が増大する。それならば差し引き0として、毎年の検診は推奨しない、とした話をしました。
それならばCIPNの治療に医療費をかけていくのはどうなのか、とも思います。早期発見が増えれば、そもそも抗がん剤の使用機会そのものを減らせることができるのですから。
間違いなく言えるのは、化学治療を受けられているとき、体調がすぐれず、運動なんて、という気持ちはわかります。それでも少しでも症状が改善し、元気な時を狙ってでも運動を心がけましょう。リハビリの技師さんは大きな病院であればどこにでもおられると思うので、化学療法前、療法中は適切な運動について指導を受けておくことも有効だと思います。まずは意識から変えてみましょう。安静を心がけているだけではいけない、ということでしょう。

付記:論文からトレーニングの具体的な内容について、翻訳してお示しします。
トレーニングセッションは研究に参加していただき、振り分けが行われた24~72時間後に開始され、治療の完了まで継続されました。これらのセッションはスポーツセラピストの監督と記録の下で行われ、約15~30分間、週に2回現場で練習され、最大の個別進行を目指しました。
◆SMT(安定性向上トレーニング)は、徐々に不安定な表面上で難易度を増すバランスエクササイズで構成されていました。各患者は標準化されたプロトコルに従って1セッションにつき4つのエクササイズを実施しました。各エクササイズは20秒間3回行われ、それぞれのセット間に40秒の休憩を取り、エクササイズ間には1分の休憩を取って神経疲労を避けました。
詳細: 感覚運動トレーニングは、運動制御を改善するために感覚系と運動系の相互作用を最適化するあらゆるエクササイズの総称です。バランストレーニングは、感覚運動トレーニングのサブカテゴリーで、不安定な表面や位置で姿勢制御を維持することを指します。この2つの用語は、しばしば著者によって同義語として使われ、混乱を招くことがあります。
私たちは主にバランストレーニングを行いましたが、患者が立てない場合には、壁や病院のベッドの端で固有感覚トレーニングも含めました。そのため、これを感覚運動トレーニングと呼びます。このトレーニングの目的は、不安定な表面で位置を維持することで神経筋系を刺激することです。最大の進行がこのタイプのトレーニングには重要であるため、正確な実施と最高の効果を確保するためにすべてのトレーニングを監督することにしました。(筆者注:バランスボードのようなものの上で立つ練習なのでしょうか?具体的にはあまり書いていませんでした。)
進行は、表面の安定性を低下させたり、二重または多重タスクを追加することで得られます。(筆者注:立ちながらスクワットをするとかでしょうか。) エクササイズの難易度は外部および患者のフィードバックに基づいて選ばれました。患者は以前に取得した位置を維持する必要がありました。このエクササイズは、神経の再生を確保するために間に休憩を挟みながら3回繰り返されました。
さらに、エクササイズ間の休憩は神経疲労(EMGで平均42秒と判定されました)を避けるために重要です。各患者は1セッションにつき3~5つのエクササイズを行いました。
◆WBV 振動トレーニングは、側面交互振動プラットフォームで行われ、患者は前足に立って、30~60秒の振動期間を4セット行いました。振動周波数は18Hzから35Hzの範囲で、振動の振幅は2mmから4mmで行われ、1分の休憩を取りました。
詳細:振動トレーニングは、側面交互振動プラットフォーム(Galileo™、ドイツ・プフォルツハイム®)で行われました。(筆者注:見る限りバランスマシーンのようです。このサイトを見てください。日本でもありそうです。)各トレーニングセッションは、30〜60秒の振動を4セット行い、振動周波数は18〜35 Hz、振幅は2〜4 mmでした。周波数が最も重要な要素であり、振動時間と位置(これは側面交互振動プレートの振幅を決定する)よりも先に変更されました。各セットの間、患者は疲労を避けるために少なくとも1分間休憩しました。患者には、前足に立つか、もし不安定であれば前足に80/20%の体重配分で立つよう求められました。非常に薄い体操用シューズやタイトで滑りにくい靴下を着用しました。
誤解しないでいただきたいのはなにかこうした運動マシーンを購入しなさいと勧めているのではありません。ただ化学治療の後からになって、何年もあの薬、このリハビリと苦労されるくらいなら、化学治療を受けているときに少し投資してでも予防するほうが結局は安く済むかもしれない、と考えていただきたいということです。
2024.07.31
乳がんの外科医は、患者に予防的両側乳房切除を勧めない傾向にあります。なぜなら、両乳房を完全に切除しても生存率は上がらないことがデータで以前から示されているからです。前回もそのことについて改めて示しました。このように大規模な疫学研究による新しいデータはそれを裏付けていますが、どう考えてもこのこと自体は不可解です。乳がん生存者で、反対側の乳房に二次乳がんを発症した人は死亡率は高い。しかしだからといいて手術でそのがんを予防しても結果は変わらないのです。
最初の乳がん、そして反対側に後になって発症した乳がん、本来はそれぞれ別のものであり、少なくとも新しいがんが、もともとあった乳がんの予後に影響を与えるはずはないはず。反対側に乳がんになった場合には予後が悪いことがわかっている。だから反対側を予防的に切除してしまった。そうすると反対側に乳がんが発生する確率はさがる。でも長期的に見て、乳がんで亡くなる確率に差が出なかった、え!?
え? え?よくわからない。
トロントのウィメンズ・カレッジ病院の乳がん研究者で医師であり、この研究の主執筆者であるスティーブン・ナロッド氏は、2000年から2019年までに乳がんと診断され、3つの手術オプションのいずれかを受けた10万人の女性のデータを比較しました。
手術を受けるすべての乳がん患者は、
1 腫瘍と一部の周辺組織のみを除去するより簡単な手術である乳房部分切除術、
2 影響を受けた乳房のみを切除する片側乳房切除術
3 両側乳房切除術 のいずれかを選択します。
片側乳房切除術のポイントは、同じ乳房へのがんの再発、つまり同側再発を防ぐことができることです。同様に、両側乳房切除術は、残された乳房でのがんの再発も防ぐ。これを行わないと、反対側乳がんが発生する確率は約7%です。
分析結果からは、3つのグループ間で生存率に大きな差はありませんでした。どの手術を受けたかに関係なく、20年間の追跡調査で女性の80%以上は乳がんで死亡しませんでした。
しかし同時に、この論文では、後にもう一方の乳房に乳がんを発症した女性の死亡リスクは4倍高いことも示されています。
そこに難問があるとナロッド氏は述べました。この結果の原因はまだ完全には明らかになっていません。

これを解決する一つの考えは、
反対側の乳がんの発生は、最初のがんからの”転移”である、という考え方です。そうであるならば、反対側の乳がんが発生した方は、転移があるのだから、予後は悪い。そして多くの場合、その転移は乳腺だけにとどまらず、肺、肝臓、骨にも検査で捕まらないような小さな転移が同時に存在することの表れであるので、たとえその反対側の乳腺を、手術の時に同時に切除していたとしても予後は変わらない。つまり乳房の予防切除には意味がないことを説明できます。
温存切除後、同じ乳房での再発は予後が不良であることと関連しています。しかし今回のことと同様に、乳房温存切除と乳房全摘除では生存率に差がありません。それは皆さんもよくご存じです。この理由と状況が似ているかもしれないということです。
基本的に乳房をすべて切除したからと言って転移再発のリスクは下がらないとされています。温存後の残った乳腺にがんが再発してきた場合、これは最初の腫瘍が非常に悪性度が高いこと、つまり転移をきたしやすいものであったことの兆候である可能性があります。温存後の乳腺にがんが再発することは、”取り残し”を意味するだけではなく、そのがんはたちが悪く、最初から全身的に何かが起こっているというシグナルとなっている、だから肺、肝臓、脳、骨も影響を受けている可能性があります。だから乳房を全摘しても温存しても結局として生命予後に影響はでないと考えられます。
これとよく似た考え方で、反対側の乳がんも、もともとの側の乳がんからの転移であるならば、同じ理屈で予後が変わらないことが説明できてしまうのです。

ただこの考え方は少し無理があります。
2007年のスウェーデンの研究では、最初の乳がん診断から5年以内にもう一方の乳房にがんを発症した女性は死亡する確率が高かったが、最初の診断から10年以上経って対側乳がんを発症した女性はそうではなかったと報告されています。先の考え方が正しいなら、短い期間に対側に発生した乳がんは、最初のがんからの転移、10年以上たってからの場合は全く新しいがん、という考え方になります。それはそれで納得ですが、一部の対側乳がんは、転移ではなく、新しい乳がんだ、ということになります。
反対側の乳腺を切除してしまえば、少なくとも新しいがんは予防できるのですから、やはり予防切除は有効でなければなりません。しかし予防切除の死亡率に与える影響は証明されていません。矛盾します。
もう一つの考え方は、がんは発生すればすべて全身病である、という考え方に基づきます。
つまり最初のがんが発生したら、治癒したように見えても転移は起こっていて、しかし何らかの理由でおとなしくしている。そして反対側の腫瘍の出現が、最初のがんから体中に散らばった悪性細胞を揺り起こし、より攻撃的な行動を引き起こす、という考え方です。最初のがんが治療された後、目に見えず、検査で捕まらない、早期の遠隔転移細胞は休眠状態にあります。そこに留まっています。何も起こらなければ、転移としてあらわれてくる可能性は低い。しかし、反対側の乳房に、あるいは温存で残された乳房にでも、2番目の腫瘍が発生し、その腫瘍が体中に自身の細胞を拡散した場合、最初のがんから転移して眠っていた転移の形成が加速される可能性がある、と考えられます。
しかしこの考え方もおかしい。だって2番目のがんは対側乳腺を切除してしまえば予防できている。2番目のがんからの刺激も起こらなくなるのだから、最初のがんからの見えない転移を刺激して呼び起こすことも予防できるはず。だったら生命予後は改善されるはずです。
今回の結果は、偉い先生方が考えても、うまく説明できる理論がないようです。
仮説すらない状況ですから、この矛盾を解決するための実験、研究も現状行いようがありません。
この矛盾をうまく説明できる理屈を考え付けば、別に何の医学知識がなくても、考え方だけでも論文で発表できるはず。それが誰からも納得できる、このおかしながんの”振る舞い”を説明できるものであったなら、大変なインパクトがあると思います。眠れない夜にどうですか?
2024.07.29
今回の話を始める前にまずは前提から。
一つ目、乳がんは、手術で完全に切除することができれば治癒します。
乳がんで命を取られてしまうのは、転移を起こすから、と言い切って構いません。乳腺はすべて切除することはできますから、がんが乳腺から出て、切除することができない臓器、肺、肝臓、脳などに転移するから命を取られます。もちろんそこだけであれば切除できますが、がんがほかの臓器に転移を起こした場合に、まず1か所で済んでいません。血液やリンパの流れに乗って全身に広がっていることがほとんどです。ですから体から完全に取り除くことができず、最終的に命を取られます。
ですので転移を起こす前に切除に成功すれば治癒させることができるのです。それを目指すことを早期発見というのです。
二つ目、一度乳がんに罹患され、治癒されている方も、対側、温存して残った乳腺に、また乳がんが発生することがあります。そしてその確率は、一度も乳がんに罹患したことのない方よりも高い。実際現在日本人女性の9人に1人、米国では8人に1人が乳がんに罹患されていますが、乳がんに一度罹患された方は、二次的に乳がんになられる確率が4人に1人まで上昇していることがわかっています。
そしてこれがまず不思議なのですが、二次的に発症した乳がんは、普通に最初に発生した乳がんより予後が悪いことがわかっています。
これを踏まえて今回の話を始めましょう。
******************************************
Giannakeas らがJAMA Oncology 誌に発表した、米国の最新の人口ベースのコホート研究の結果によると、片側乳がん患者は、対側乳がんを発症すると乳がん関連死のリスクが増加することが明らかになりました。また、この研究結果では、両側乳房切除術を受けた患者では二次悪性腫瘍を発症するリスクが減少することも示されましたが、この方法は死亡率に影響を与えなかったようです。
Giannakeas V, Lim DW, Narod SA: Bilateral Mastectomy and Breast Cancer Mortality. JAMA Oncol 2024.
乳がんになったら両方の乳腺を切除してしまわれる方がおられることを、驚かれる方もいると思います。しかし片側だけ残しても帰って整容性が悪く、服装も気を使うとのことで、その後に対側に乳がんが発生する不安から、両方とも切除される方は米国では意外におられるようです。
ただこの研究結果、大変不思議な結果になっています。
というのも、対側に発生する乳がんは、それはそれでそこから転移する可能性のある新たな原発腫瘍であると一般的に考えられています。私も考えていました。
予防的に対側の乳房を切除すれば、もちろん対側に乳がんが発生する頻度は下がります。
しかしそのことによってその患者さんが乳がんによって死亡する確率が変わらなかったのです。
これは大変奇妙なことです。対側乳がん後の死亡率増加が、全く独立した新しい乳がんからの転移によるものであるならば、両側乳房切除術が有益でなければなりません。
研究者らは米国の登録データベースを使用して、2000年から2019年の間にステージ0からIIIの片側浸潤性乳がん(n = 564,062、85.3%)または乳管内癌(n = 97,208、14.7%)と診断された661,270人の患者(平均年齢= 58.7歳)を特定しました。
この集団のほぼ4分の3は最初に乳房温存手術を受け、残りの患者は片側(23.4%)または両側(6.0%)乳房切除術を受けました。
両側乳房切除術を受けた人の合計90.7%をマッチングさせ、同じサイズの3つの外科コホート(コホートとは同じ時期に同じ出来事を経験した人たちのグループという意味になります。実際の数 = 36,028)を確立することに成功しました。
この3つのコホート、つまり片方の乳腺に浸潤癌が発生し、温存手術を受けた方、全摘を受けた方、そして両方とも乳房を切除された方の3つのグループは、対側乳がんの発生、および乳がんによる死亡率について20年間追跡調査されました。データ分析は2023年10月から2024年2月の間に実施されました。

◆対側乳がんリスク
20年間の追跡期間中、乳房部分切除術、片側乳房切除術、両側乳房切除術を受けた患者で、それぞれ合計766例(コホートの2.1%)、728例(2.0%)、97例(0.3%)の対側乳がんが記録されました。
最初の原発腫瘍から対側乳がん発症までの経過期間の中央値は5.0年(範囲=2.3~8.6年)でした。
乳房部分切除群と片側乳房切除群を合わせた対側乳がんの年間リスクは0.3%、20年リスクは6.9%(95%信頼区間[CI] = 6.1%~7.9%)と報告しました。もちろん両側切除を受けられた方では対側乳癌はほぼ発生しません。
◆乳がんによる死亡率
15年時点で、乳房部分切除群と片側乳房切除群を合わせた乳がんの累積死亡率は、対側病変を発症した患者では32.1%、発症しなかった患者では14.5%でした。
対側病変を時間依存共変量として使用すると、乳がんによる死亡のハザード比は4.00(95% CI = 3.52~4.54)でした。これはもし乳がん術後、対側の乳がんをもし発症してしまうと、その後、乳がんによって死亡する確率が4倍になる、ということです。もちろんそれは元の乳がんからの転移、新しい乳がんからの転移、その両方によります。
乳房部分切除、片側乳房切除、両側乳房切除を受けた患者のうち、それぞれ合計3,077人(8.5%)、3,269人(9.1%)、3,062人(8.5%)が乳がん関連死を経験しました。乳がんによる20年間の累積死亡率は、乳房部分切除術後では16.3%、片側乳房切除術後では16.7%、両側乳房切除術後では16.7%でした。つまりこの3つのコホートで、対側乳癌の発生率には差があるにもかかわらず、結局として死亡する確率には全く差がなったのです。
「これらのデータに基づくと、乳がんの女性 1,000 人中 69 人が診断後 20 年以内に対側がんを発症すると予測されます」と研究者らは結論付けています。「対側乳がんを発症した後、研究対象者における死亡率は、対側がん発症時から追跡調査終了時まで 4 倍に増加しました。しかし、片側乳がんに対して両側乳房切除術を受けた患者は、片側手術を受けた患者と同等の死亡率でした。」
これは大変奇妙な現象です。なぜこんなことになるのでしょうか。
2024.07.28
このブログでも、2024年に発表された米国予防サービスタスクフォース(USPSTF)による最新の乳がん検診の勧めについて、何度も、それこそ何度も触れてきました。
・米国予防サービスタスクフォース(USPSTF)による最新の乳がん検診の勧め
・米国予防サービスタスクフォース(USPSTF)が乳癌検診に関する新しい草案勧告を発表しました
・米国予防サービスタスクフォースが乳癌検診に関する新しい草案勧告を発表しました(続)
・米国予防サービスタスクフォースが乳癌検診に関する新しい草案勧告を発表しました(続続)
これらは今までの乳がん検診をご存じの方からすれば、乳がん検診の開始年齢の推奨を50歳から40歳に引き下げただけに映ります。最新の推奨では繰り返しになりますが、「40 歳から 74 歳までの女性に 2 年に一度のマンモグラフィ検査を推奨しています」となります。
ただ推奨の文章や、内容を詳細に読み込んでいくと、年齢の引き下げに関することよりも、毎年よりも隔年(2年に1回の”方が”いい)と強調されていることに気が付きます。毎年受けることはむしろ”害”がある、という風に書かれているのです。この記載の影響が実は最近大きく問題になっているのです。
2024年7月15日のMEDPAGEの記事によれば、施行されたアンケート調査によって、検診に関する知識が深まると、40代の女性の多くがマンモグラフィ検査を控える傾向にあることが報告された。 調査対象となった女性の3分の1以上が、過剰診断、つまりマンモグラフィ検診の害についての情報を「驚くべきもの」と感じたようです。
「え!?害があるの?」と思われた方はもう一度、「米国予防サービスタスクフォース(USPSTF)による最新の乳がん検診の勧め」の記事を参考にしてください。
米国では、乳がん検診の開始を検討している方に対して、意思決定ツールというものが配布されています。このツールについて簡単に説明すると、もともと検診は自分の意思で受けるものであり、半年に1度だろうが、2年に1度だろうが、極端な話、一生受けないでいようが本人の勝手です。ただ受けようという意思をお持ちの方に、どのように受ければ最善なのか、ということを考えるのは意外に難しい問題です。毎週受けてください、それが一番安全です、なんて言われても困るでしょう。被ばくは問題にならないんですか?すぐにそういう疑問がわきます。
だからツールではまずその方の乳がんの罹患リスクを”計算”することから始めます。
残念ながらこうしたツールのほとんどは英語で書かれており、皆さんには敷居が高いかもしれません。たとえば比較的入力項目が少なくて、簡単に使用できる、米国の厚生労働省に相当するNIHが提供しているBreast Cancer Risk Assessment Tool: Online Calculator (The Gail Model) を紹介し、使ってみます。
たとえば
1 いままで乳がんを含めて、DCIS、LCISと診断されたことはない。そして何らかの理由で胸に放射線治療(胸部レントゲン写真は除く)を受けたことはない。
2 遺伝子検査でBRCA1 あるいは2、それ以外の異常も含めて指摘されたことはない。
3 48歳の日本人である。
4 今まで検診で所見ありとされ、生検を受けられたことがある。幸い癌ではなかった。
5 初経は11歳から
6 最初に出産したのは30歳のとき
7 お母さん、娘、姉妹に乳がんの方が一人だけおられる。
これで計算できます。
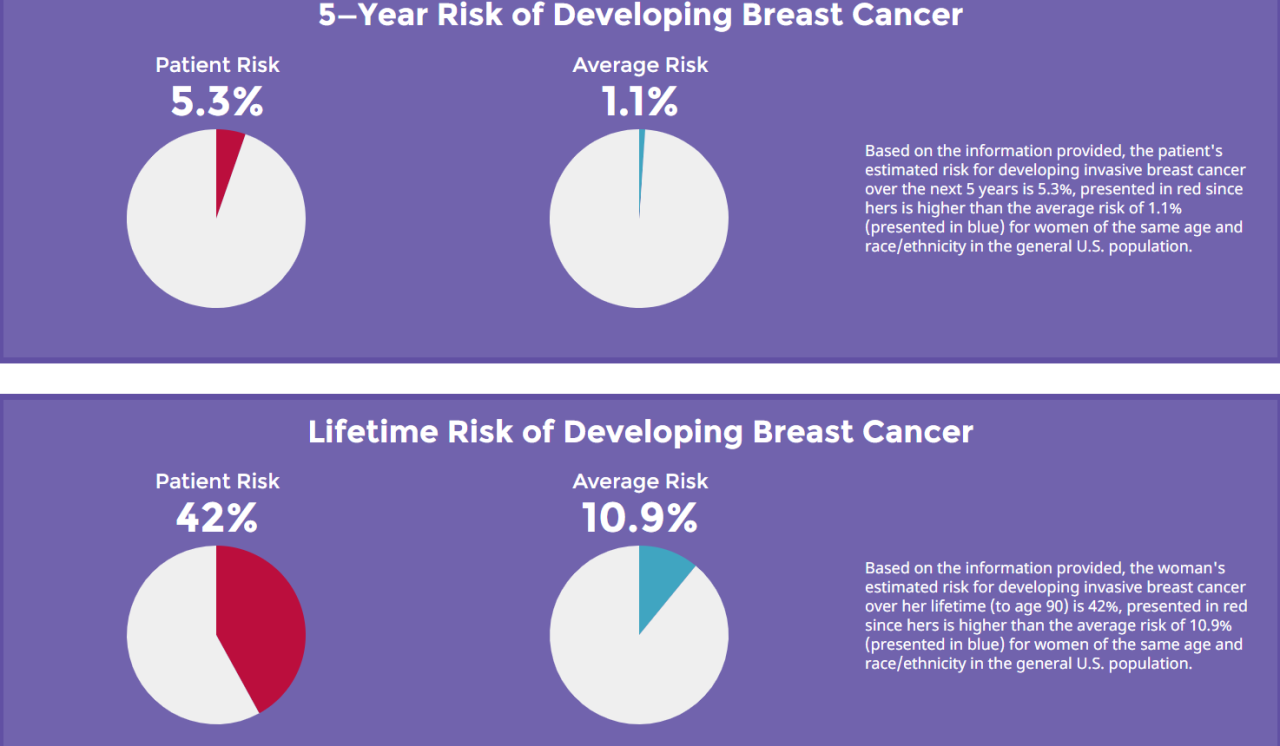
結果が上記になります。上の段の見方は、「これからの5年間で貴方が乳がんを罹患するリスク」です。貴方と同じ年齢の女性の平均は1.1%、しかし貴方自身は5.3%もあります。
人生全体で見たときのリスクが下段です。貴方と同じ年齢の女性の平均は10.9%、しかし貴方自身は42%もあります。
貴方は □ 平均よりも乳がんに罹患するリスクの高い方 になります。
同じようにして計算すれば、平均の方、平均より低い方、に分類されることになります。
そして米国予防サービスタスクフォースの推奨、40歳から隔年のマンモグラフィの施行、は平均か、それ以下のリスクとされた方への推奨となります。リスクの高い方へは、別の考え方をする必要があるのです。
またこれも以前に述べましたが、マンモグラフィ検査で、「高濃度乳腺である」と診断された方、75歳以上の方に関しては、この米国予防サービスタスクフォースの推奨は当てはまらない、とされています。
そう考えると、この40歳から74歳まで隔年でのマンモグラフィ検査、の推奨の対象に当てはまる方は意外と少ない、ということになりそうです。
しかしそれでも今回の推奨を読み込み、検診に関する知識が深まると、40代の女性の多くがマンモグラフィ検査を控える傾向にある、のです。
米国での全国オンライン調査によると、マンモグラフィ検査のメリットとデメリットに関する情報の提供を行うマンモグラフィ検査の意思決定支援ツールにより、平均リスクしかない40代女性では、マンモグラフィ検査を延期したいと考える方の割合は増加しました。実際には意思決定支援ツールを見る前は、39歳から49歳の女性の27%が検査を延期したいと考えていましたが、ツールで学習した後には38.5%に上昇しました。
また、調査では、意思決定支援ツールを見た後、現在の年齢でマンモグラフィ検査を受けることを望む女性が事前には67.6%であったのに、それが57.2%まで減少した。さらに開始を50歳まで待つことを望む女性が増えた(8.5%が18%に増えた)ことも明らかになりました。
どのような情報が彼女たちの見解を変えたのでしょう。
調査対象となった女性の37.4%が、意思決定支援ツール内の、過剰診断に関する情報に「驚いた」と答え、28.1%が医師から言われたことと違っていたと報告しています。
やはりこのツールで提供される、マンモグラフィ検診の”害”についての情報がこの傾向を生み出していることがわかります。過剰診断による害とは、貴方が乳がんでもないのに乳がんの疑いがあるとされる、あるいは乳がんがあるのに、ないとされることを含みます。それによって不必要な治療を受けるデメリットも含みます。意思決定支援ツールでは、過剰診断リスクがスクリーニングでがんとして発見された異常全体の割合(12~22%)として提示されています。これではその”害”に直面する頻度が、非常に高いように感じます。
しかし実際医は 絶対数、つまり検診を受けられた方全体でみれば、1,000人あたり1~3件に過ぎず、そうして提示された場合よりもリスクが高いと認識される可能性があると思われます。
今回の改正では、検診の対象範囲(年齢)が拡大されましたが、同時に情報提供によって、受診を自分から控える人が増えるという皮肉な結果につながっているようです。これでは本末転倒のように思います。
たとえば抗がん剤、それこそ目薬であっても、薬には必ず副作用があります。しかし薬は副作用のために使用するのではありません。効果のために使用するのです。効果が十分に伝わっていないのに、副作用の説明ばかりしてしまえば誰だって使用をためらいます。
隔年を毎年にすれば害、貴方が乳がんでもないのに乳がんの疑いがあるとされる、あるいは乳がんがあるのに、ないとされることを含みます。それによって不必要な治療を受ける、そういう機会が10%増えます。しかし隔年を毎年にすれば、乳がんによる死亡率が10%下がります。
そもそもこの数値を比べていることがナンセンスです。
白菜を市場に運びたい、でもあと1㎏が載せられない。ここで捨てるしかなくなる。
だから今馬車に乗せている金塊1㎏を捨てて行こう、みたいに聞こえます。
どちらにしても、主治医としっかり話し合って、自分なりの乳がん検診の在り方をしっかり把握して、受けていかれるようにしていただきたいものです。
まとめ
・米国で推奨されている乳がん検診は、隔年でのマンモグラフィ検査の実施です。しかしそれは乳がんの平均リスクの方を対象としており、平均以上のリスクのある方は含みません。加えて高濃度乳腺である方、40歳以下、74歳以上の方を含みません。
・たしかに検診にも害はあります。ただ害だけをみて判断することは間違いです。すべてはバランスによるものです。メリットデメリットをしっかり把握して、自分に最善の検診の在り方を考えていきましょう。
2024.07.19
メディケア(米国の保険制度)患者を対象とした遡及的研究によると、乳がんを患う高齢女性に対するホルモン療法を施行した場合、その後のその患者さんの認知症リスクの低減と関連していることが示唆されました。サウスカロライナ大学コロンビア校のチャオ・カイ博士らがJAMAネットワークオープンで報告しています。Cai C, Strickland K, Knudsen S, Tucker SB, Chidrala CS, Modugno F: Alzheimer Disease and Related Dementia Following Hormone-Modulating Therapy in Patients With Breast Cancer. JAMA Network Open 2024, 7(7):e2422493.
ホルモン療法を受けた乳がん患者は、ホルモン療法を受けなかった患者と比較して、平均12年間の追跡期間中に認知症のリスクが7%低かったとのこと。(HR 0.93、95%CI 0.88-0.98、P =0.005)しかしその効果は年齢によって反対の効果にもなっていたようです。
認知症のリスク低下は、65~69歳の乳がん患者群で最も顕著に認められました(HR 0.48、95% CI 0.43~0.53)。しかしこの関連性は加齢とともに減少しました。
80歳になると、ホルモン療法の使用は認知症リスクとの正の関連性に移行し(HR 1.40、95% CI 1.29~1.53)、90歳以降までその傾向が続きました。
またこの効果は人種によっても異なる結果になっており、ホルモン療法を受けた65~74歳の黒人乳がん患者では、相対リスクが24%減少しました(HR 0.76、95% CI 0.62~0.92)。同じ年齢層の白人乳がん患者では、相対リスクが11%減少しました(HR 0.89、95% CI 0.81~0.97)。
「ホルモン治療のような特定の治療法から、認知症リスクの低減という恩恵を受ける可能性のあるのは、特定の一群であり、全員には当てはまらない」と、Cai氏は語っています。「結果を最適化し、リスクを最小限に抑えるためには、患者の年齢や人種などの個人的要因を考慮するべきである。」

薬剤ごとの認知症への影響も、人種によって異なるようです。
65~74 歳の黒人女性の場合、アロマターゼ阻害剤の使用は、SERM(タモキシフェンなど)(HR 0.80、95% CI 0.57~1.11)よりもわずかに強い関連性を示しました(HR 0.73、95% CI 0.59~0.91)が、SERMに関する知見は有意ではなかった。
65~74 歳の白人女性では、SERMによりリスクが有意に減少しました(HR 0.81、95% CI 0.70~0.94)。
多くの乳がんはホルモン受容体陽性で、エストロゲン(女性ホルモン)ががん細胞の増殖に及ぼす影響を阻止するためにホルモン療法で治療されています。ホルモン療法は乳がんの生存率を高める可能性があるが、認知機能の低下との関連も報告されていると、カイ氏と共著者らは指摘しました。過去の研究では、ホルモン療法との関連はないという反対の結果もあり、逆にホン論文のようにホルモン療法による予防効果があるとするもの、または認知症リスクの増加が示されたなど、一定した結果は出ていませんでした。
話はそう単純ではないようです。
Chai氏らは、がん登録データとメディケア請求を組み合わせた監視、疫学、SEERとメディケアの連携データベースを使用して、2007年から2009年の間に新たに乳がんと診断された65歳以上の女性を特定してかいせきしました。認知症の既往歴がある患者や、乳がんの診断前にホルモン調節療法を受けていた患者は除外しています。彼らは、がん治療のためにホルモン療法を受けた女性と受けなかった女性を比較し、乳がんの診断から2019年末まで最低10年間追跡調査しました。ホルモン療法を受けているかどうか、の定義に関しては乳がんの初回診断から3年以内に、タモキシフェンなどのSERM、アロマターゼ阻害剤、ゾラデックスなどの選択的エストロゲン受容体分解薬など、少なくとも1種類のホルモン調節薬の投与を開始したことと定義しました。合計で 18,808 人の女性がこの研究に含まれ、そのうち 65.7% がホルモン療法を受けていました。最も一般的な年齢層は 75 ~ 79 歳で、女性の 80% 以上が白人、約 7% が黒人でした。ほとんどの女性 (76.1%) がアロマターゼ阻害剤によるホルモン療法を開始していました。
衝撃的な内容だったので、ここで紹介しました。ホルモン療法と認知症リスクには何らかの関係がありそうではあるのですが、実際の治療で認知症リスク改善を狙って投与することは時期尚早でしょう。そもそも人種ごとに差があると書いているのに、アジア系の人の調査は行われていません。
ホルモン剤が投与されていない乳がん患者さんはトリプルネガティブ乳がんが、HER2エンリッチ乳がん症例のはずです。投与されているひとはルミナールタイプです。こうした乳がんのサブタイプごとの発生リスクと遺伝の関係は絶対ではありませんが、0ではありません。ホルモン剤が直接認知症を抑えているのではなくて、ルミナールタイプの乳がんになりやすい遺伝子を持った方が認知症になりにくいのかもしれません。またホルモン剤を投与されている方は投与されていない方よりもどうしても医療機関を受診する機会が増えます。そのため高血圧や、糖尿病など、認知症リスクに直結する疾患が早く見つかり、治療されているからなのかもしれません。
ホルモン療法と認知症に関するさまざまな研究は以前から行われているようです。しかしこういうテーマで研究を行う場合、遡及的研究(いままでの過去の症例をさかのぼって検索すること)設計では、なかなか思うような結果には至らないことが多いのが現実です。
あえて認知症の発症に研究対象を絞って、健康な人を、ホルモン剤を投与した群としなかった群に分けて調査する必要があります。それだと本来ホルモン剤が必要でもなんでもない人に何年も投与することになってしまうことを考えると、真の答えを見つけるのは難しいかもしれません。
2024.07.17
「私はきちんと2年に1回 マンモグラフィ検診を受けているから大丈夫」
以前にも触れましたが、米国予防サービス特別委員会 (USPSTF) による乳がんスクリーニングガイドラインでは、すべての女性が40歳から隔年で乳がんの検査を受けることを推奨しています。これはしかしBグレードの推奨です。Aではありません。隔年、あるいは毎年でもマンモグラフィによる乳がん検診を受ければ、乳がん死は抑制されるという確実な証拠があります。これは間違いない。ならばなぜBなのでしょうか。
その勧告は、科学的証拠に基づいて評価され、勧告の強度はAからDまでの等級で示されます。A等級は高い推奨度を示し、D等級は効果がないか、または害があるという証拠があることを示します。
最新のガイドラインでは、開始年齢が引き下げられ、40歳から隔年で乳がんの検査を受けることを推奨していますが、これはBグレードの推奨とされ、純利益が中程度である、または中程度の効果があるという高い確実性があることを意味しています。なぜAではないのでしょうか。
もし本当に”きちんと2年に1回 マンモグラフィ検診を受けているから大丈夫”であるのなら、それを1年に1回、そして半年に1回、3か月に1回としていけば、ほぼ100%大丈夫、でなければなりません。
しかし少なくとも1年に1回で北斗さんや、小林麻央さんの例があるように100%大丈夫ではありません。早期発見できないこともある。では半年、3か月に1回ではどうでしょうか?
これも前述しましたが、米国予防サービス特別委員会 (USPSTF) による乳がんスクリーニングガイドラインはMonticcioloをはじめとする研究者らによる、がん介入・監視モデリングネットワーク(CISNET)の2023年乳がんスクリーニング結果に基づいて定められました。研究者らは乳がん検診の利点とリスクを以下の4つの異なるシナリオで比較しました。
結論として、Monticcioloは、40歳から79歳の女性を対象にデジタルマンモグラフィまたはトモシンセシスによる年1回のスクリーニング(つまりシナリオ4)により死亡率が41.7%減少することを発見しました。一方、シナリオ1では25.4%減少し、シナリオ2では30.0%減少しました。
つまり2年に1回を、1年に1回にしても乳がんで死亡する確率を10%下げるだけだったのです。
私の医療圏では140名の方が亡くなっていると言いました。2年に1回の検診を1年に1回の検診に倍に増やしても、140名が120名になるだけなのです。それが小さいとは言いません。ただ医療コストは単純に倍になるので、それに見合わないとは言えると思います。
ましてやこれでは「私はきちんと2年に1回 マンモグラフィ検診を受けているから大丈夫」とは言えないのではないでしょうか。推奨グレードAとはとても言えないでしょう。

例えば毎年歯科受診をしている方は、受診していない方よりも齲歯は少ない。
学校以外に塾に通う子は通っていない子より成績がいい傾向がある。
ただそれは歯科医が何かしたからよりも、そういう人の方が、日常での意識が高く、しっかり気を付けて歯磨きをするからではないのでしょうか?年1回の歯科医の処置よりもその方が大きいのではないか。
塾も、週に1-2時間受けている講義で何を習っているかよりも、そういう意識がある子の方が普段から勉強する傾向が高いから成績が良くなるのではないでしょうか。
隔年のマンモグラフィ検診で、乳がんを全例確実に早期で発見できるから乳がん死の抑制効果が出ているのではない。検診を受けておられる方は、普段から乳腺に気を付けて自己検診をしており、気になったらすぐに施設を受診する心構えができているから、乳がん死が抑制できているのではないか。
ちなみに検診を定期的に受けておられる方が、それでも検診ではなく、ご自分で腫瘤に気づいて乳がんを発見してしまう場合、これを中間期乳がんと言います。
Orsiniらの研究によれば、定期的に検診を受けている方で、検診と検診との中間期に自覚症状で発見される乳がん症例は全発見症例の28.9%にのぼり、その腫瘍の平均サイズは18mmでした。
Orsini L, Czene K, Humphreys K: Random effects models of tumour growth for investigating interval breast cancer. Statistics in Medicine 2024.
逆に定期検診を受けないから乳がん死に至るのではなく、定期検診を受けない方は、乳腺に関心がないから進行するまで乳がんを放置していて死に至るのではないか。
私が経験した過去3年以内に検診歴のない自己発見乳がん症例1541例における腫瘍サイズは触診では24.0mm、病理切片上では23.4mmでした。同じ自分で触って乳がんを発見したとしても、検診を定期的に受けられている方ではサイズを小さく見つける傾向があります。検診を受けられない方は進行して見つかる、それは常識ともいえるがそれは検診が直接的に影響しているだけではないのかもしれません。
早期発見にこだわらないとすれば、もともと乳がんは検診を受けなくても自己チェックで発見できます。だとすれば隔年施行されるだけの乳がん検診の精度をあげることよりも、乳がん検診の受診率をあげることの方が乳がん死の抑制効果はよほど大きい可能性が高いといえます。さらにそれによって自己検診をさせる動機付けを行い、日常の乳がんに対する意識を高めることで乳がん死を抑制することに貢献する効果も無視できないのではないでしょうか。
われわれ検診クリニックは、来られた患者さんの乳がんを早期発見することはもちろん必須です。
でもおなじくらいの努力が、受診される方の動機づけと、その方の日常の意識改革、自己検診の教育に向けられていなければならないのではないか、そう思います。
2024.07.17
最近 投稿が滞っていました。少しつれつれ雑談をしてみようと思います。
今年も日本乳がん学会総会が仙台で開催されました。
3日間の日程ですが、雨にたたられっぱなしで学会会場にこもっているしかない、という状況は、勉強熱心な学会会員の皆様には何ともないかもしれませんが、せっかく仙台まで来たのだからと思っている私のような人間には少し残念なお天気になりました。学会会場のそばに伊達政宗の銅像がある青葉城があったりするのですが、散歩をして上がるのにも雨は降る、蒸す、足はべたべたする、メガネは濡れる曇る、でさんざんです。
日程の間を縫って、レンタカーを借りて松島まで行ってみることにしました。
夕方の風景を期待してワイパーを振りながら松島につきましたが、しっかり雨。ガスっていて遠景は期待できません。それでもと思い、遊覧船乗り場についてみたら16時が最終とのこと、着いたのは16時半でしたからあきらめざるを得ませんでした。調べてから行けよ、声が聞こえます。夏は日が長いので時間間隔がくるっていたようです。運航しているかなと。まあ考えてみれば当たり前の時間ですね。
仕方なく、車でうろうろして少しでも長めのいいところを探しました。

日本三景の一つですが、こういう細かな島が点在している風景は瀬戸内の風景を見慣れている私には普通のことです。松島を松島たらしめているものは、やはり自生している?、もしかしたら植えたのかもしれませんが、島を植えつくすように茂っている立派な松の森なのだな、とわかりました。
日本画を好む人たちにはたまらない風景なのだろうと思います。
雨ですが、日本画どころか水墨画ならそれもまたよしなのでしょうか。
思い出されるのは東北の大震災です。津波はここまで来ていたはずですが、松が損傷を受けたようには見えませんでした。複雑に入り組んだ島や、それこそ生い茂る木々が防波堤の役割を果たしたらしく、大きな被害にはならなかった、と聞きました。古刹はもともとそうした土地を選び、立てられているからこそ古刹なのであって、そういう何百年も経たような古い建物がたくさん残っているような土地はもともと災害にも強いのだろうな、と思いました。
さてそろそろ乳がんの話
基本的に我が国の医療は皆保険制度によって成り立っています。しかし検診は原則自費です。最近では企業や自治体が補助をしてくださって、無料で受けられる検診もありますが、その意味からは皆さんは決して安くない金額を払って検診を受けられているわけです。
その意味からは来院される方の“ニーズ”に私は答えなければなりません。とはいえ来院される方のニーズは人それぞれであり、また誤解されている方もおられます。ただ我々は乳腺クリニックです、比較的ニーズは絞られます。
乳腺クリニックを検診目的で受診される方の究極のニーズは自らの乳がん死を無くすこと、です。
検診は何回受けても、どれくらいの頻度で受けられたとしても、乳がんにならないようにはできません。執筆時2024年に開催されている日本乳癌学会総会では現在年間約9万人の日本人女性が新たに乳がんと診断され、うち約1万4,000人が乳がんで亡くなっていると提示されました。約15%が亡くなっている計算になります。
私の施設の医療圏は100万人なので、私以外の先生も含めて、日本の人口の1億人のうちの100万人、100分の1を担当しています。日本で年間9万人が乳がんになられるのなら私の地域では900人が乳がんに罹患されている計算になります。そしてその15%である140人の乳がんで亡くなってしまう運命を変えることが役割になります。
しかし私は乳がんを治療する立場にない。治療はできません。検診を生業にしています。
誤解を恐れずに言いますが、その患者さんの乳がん死を無くす、という大きな目標においては、基幹病院などの治療施設よりもわれわれの方が役割は大きいと思っています。
乳がんの診断がつき、治療施設を受診した時には実はその乳がんが死に至らず、治癒するかどうかもう確率的に決まっています。治療施設はガイドラインに決められた内容を決められた手順通りに行っています。したがって治療施設が最大限の努力をしているのは、標準治療に劣ることのないようにはすることであり、それが当然ではありますが、それによって治癒する確率は決まっています。保険診療の範囲は限定しているのでなおさらです。
もしかすると現在行われている臨床試験の中には将来標準治療になるような、現状を変えてしまうような治療法や薬剤があるかもしれません。しかしそれは誰にもわかりません。もしかすると標準治療よりも劣るかもしれない。保険適応でもありません。
その方を乳がんで亡くなる運命から救う、それには治癒可能な早期で発見するしかないのです。幸い現状でも浸潤性乳がんのステージIの5年生存率は99%に達しています。我々の地域の年間900人乳がん患者さんの全員が早期で発見される、それが達成できれば事実上ほぼ乳がん死は亡くなります。そしてそれができるのは、私のような最前線の検診施設なのです。
私たちは乳がんで亡くなる方を0にすることを目指して、一人でも多く早期発見し、治癒する段階で見つける努力を継続することが使命になります。具体的には目指すものは二つ、乳がん検診の受診率を100%とする。乳がん検診の早期発見の精度を100%とする。この二つでしょう。そしておそらく前者の乳がん検診の受診率をあげる、これがもっとも効果が大きい。
しかしそれが一番難しいことでもあります。
ご予約専用ダイヤル
079-283-6103