2025.10.25
線維上皮性病変(Fibroepithelial Lesions; FEL)は、線維腺腫(fibroadenoma;FA)と葉状腫瘍(phyllodes tumor; PT)の両者を含みます。これらはいずれも上皮成分と間質成分を併せ持つ二相性腫瘍(biphasic tumor)であり、構造的にも類似しています。
(乳腺は間質成分に支えられる上皮成分(ミルクを作って運ぶ)で構成されています。ケーキのクリーム(上皮)とスポンジ(間質)みたいなものです。これがしっかり分かれているのが良性、つまり二層性が保たれているといいます。がんではこの二層性が壊れてごっちゃになっているのが特徴です。ちなみに”相”と”層”がごっちゃになっていますが、故意に使い分けています。)
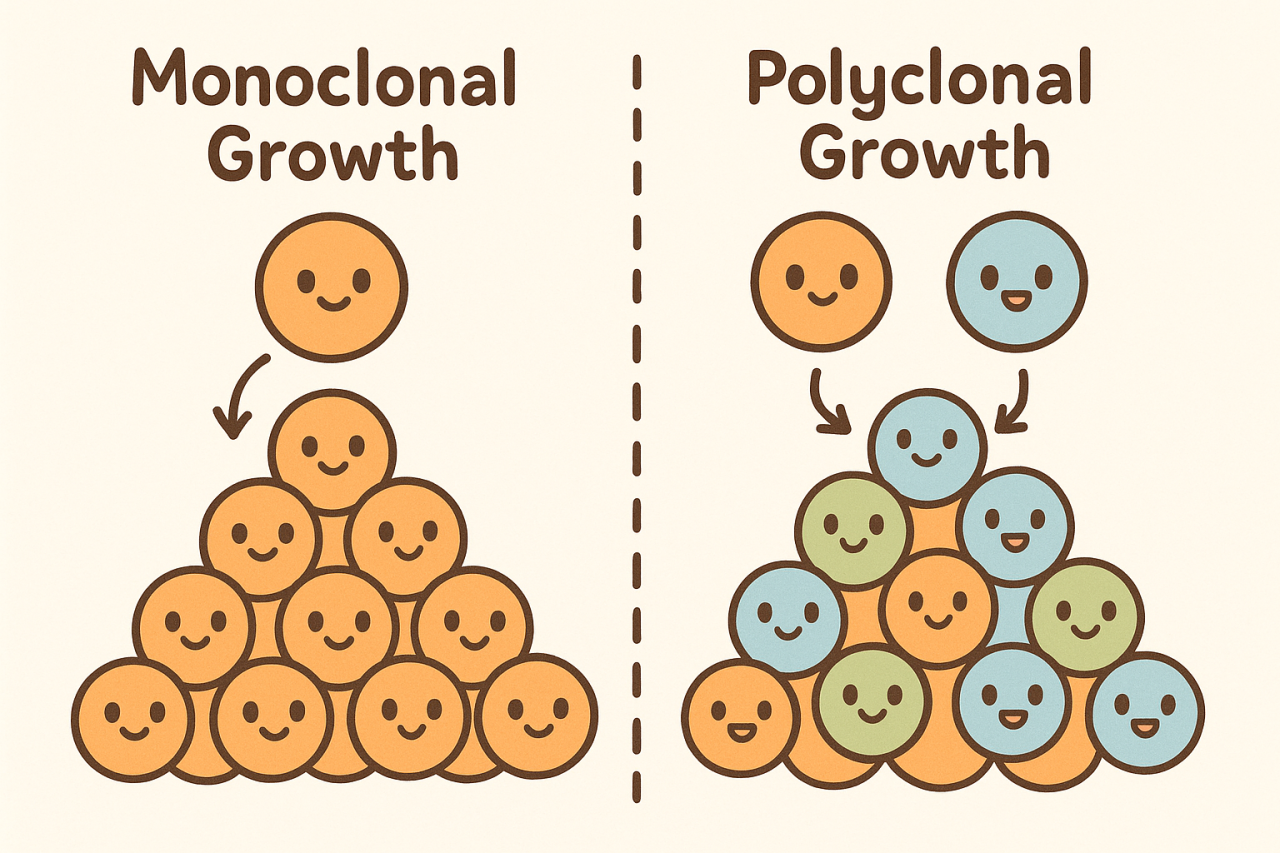
初期のゲノム研究では、線維腺腫は上皮成分・間質成分のいずれも主にポリクローナルであることが示されました。これは、線維腺腫が刺激によって起こる可逆的な過形成であることを示唆しています。(注:これも難しいです。クローナル(clonal)**とは、「1つの細胞が異常を起こして増殖し、同じ性質をもつ細胞集団(クローン)をつくること」を意味します。モノクローナル(monoclonal)であれば、がんや腫瘍のように、1個の細胞の遺伝子変化から始まった異常な増殖を示唆します。一方、ポリクローナル(polyclonal)とは、「複数の細胞がそれぞれ独立に増えている状態」であり、特定の“がん化細胞”が優勢になっているわけではありません。
つまり、ポリクローナルな増殖は、がんのように異常をきたした細胞が増え続けてしこりになっているのではなく、いろいろな細胞がそれぞれで増殖しているので、反応性・過形成的(非腫瘍性)な増殖を意味します。ただ線維腺腫ではMED12という遺伝子に異常をきたしていることも指摘されており、あくまで現時点ではそう考えられている、ということにとどまります。)
線維上皮性病変(FEL)の診断に関して病理医間で差があるため、臨床医は施設内の病理医と報告基準について相談すべきとされます。施設によっては線維腺腫と線維上皮性病変(FEL)を区別せず報告することがあり、その場合でも臨床的・病理学的に良性葉状腫瘍が疑われる病変は切除すべきとされます。
臨床的にもこの考えは支持されており、
・思春期や妊娠期にみられるホルモン依存性の発育、
・通常2〜3 cm程度で成長が停止すること、
・時間の経過とともに自然退縮すること、
などがその根拠です。
一方で、葉状腫瘍も上皮成分はポリクローナルですが、間質成分は主にモノクローナルであり、これは腫瘍性に増殖していることを示唆します。そのため、時間経過による成長停止や病変が自然に小さくなることがないのが特徴です。
良性葉状腫瘍と診断された患者では、多世代にわたる家族歴を確認することが推奨されます。また、個人や家族のがん歴を踏まえた上で、生殖細胞系列遺伝子検査*の実施を検討する必要があります。
最近の研究では、葉状腫瘍患者250例のうち12.1%において、病的または病的の可能性が高い生殖細胞系列変異が認められ、その半数以上が常染色体優性遺伝のがん関連遺伝子に存在していました。
画像所見と一致する乳腺コア針生検は、線維腺腫の診断において非常に高い精度を示します。しかし、一部の症例では線維腺腫と葉状腫瘍の鑑別が困難な場合があり、そのような症例では良性線維上皮性病変(benign FEL)という診断名が用いられることがあります。
一般的に、コア針生検は低い偽陰性率を持ち(がんを、誤ってがんではないと診断してしまうことを、偽の陰性として偽陰性と呼びます)乳腺疾患診断の標準的手法とされています。
また、アメリカ放射線学会が定める「超音波ガイド下経皮的乳腺介入手技の実施基準によれば、超音波ガイド下のコア生検は外科的切除生検と同等の精度を有すると報告されています。
2025.10.25
ASCOから乳腺の良性疾患の取り扱いに関するガイドラインが出ました。良性疾患についてはそもそも研究がなされる機会が少なく、治療も含めて対応方法がしっかりと示されていませんでした。ここでは学会として初めて指針を出した点で、我々医師にとっても大変重要なものになります。
今回は良性葉状腫瘍の取り扱いについて触れている表を示します。
| 項目 | 合意 |
|---|---|
1. 一般的コメント | |
| 1a. 良性葉状腫瘍(BPT)患者では、乳がん・卵巣がん・膵がん・大腸がん・肉腫・Li-Fraumeni関連腫瘍などを含む包括的ながんの家族歴を取得し、遺伝性腫瘍症候群が疑われる場合は遺伝カウンセリング/遺伝学的検査を検討すべきである。 | 強い合意 |
2. 画像診断 | |
| 2a. 手術的生検前には、すべての患者で年齢に応じた対側乳房の診断画像検査を行うべきである。 | 強い合意 |
| 2b. BPTと診断された患者に対しては遠隔転移の評価は不要である。 | 強い合意 |
3. 外科的切除の適応 | |
| 3a. 乳腺コア生検で線維上皮性病変(FEL)と報告された場合、その病変は外科的切除の対象とすべきである。 | 強い合意 |
| 3b. コア生検または吸引式生検で葉状腫瘍の疑い、否定できない、あるいは懸念が示された病変は、外科的切除生検を行うべきである。 | 強い合意 |
4. 手術手技 | |
| 4a. コア生検で線維上皮性病変(FEL)と診断された患者では、陰性切除縁を意図せず、病変の完全切除を行うことが推奨される。 | 強い合意 |
| 4b. 葉状腫瘍の疑い・否定不能・懸念を示す病変に対しても、腫瘤を切断または細断せず完全切除を行うべきである。 | 強い合意 |
| 4c. 線維上皮性病変(FEL)または良性葉状腫瘍の切除においては、局在化法の手法に優劣はない。必要に応じて選択すればよい。 | 強い合意 |
| 4d. 急速な増大・多数の有糸分裂像・間質拡張を伴う大きな線維上皮性病変(FEL)または良性葉状腫瘍では、陰性マージンを確保する切除を考慮してよい。 | 強い合意 |
| 4e. 良性葉状腫瘍に対して細断・切断を伴わない完全切除が行われた場合、陰性切除縁は不要である。 | 強い合意 |
| 4f. 良性葉状腫瘍が不完全切除であった場合、腫瘤が切断されていた、あるいは残存病変が疑われる場合には、再切除を考慮すべきである。 (この記載は4e、4gと矛盾して読める。これは外科医はとり切れている、と判断している、けれども病理医は顕微鏡で見ると残っている可能性がある、と診断された場合を想定するとわかる。外科医が取りきれたと判断しているのなら、顕微鏡レベルで残っている可能性が示唆されても再切除は不要、と述べている) | 強い合意 |
| 4g. 良性葉状腫瘍で腫瘍陽性マージンがあっても、再切除は不要である。 | 強い合意 |
5. 非手術的管理 | |
| 5a. 良性葉状腫瘍患者に対しては、陽性マージンを含むいかなる場合でも放射線治療は不要である。 | 強い合意 |
6. フォローアップ | |
| 6a.線維上皮性病変(FEL)や葉状腫瘍の疑い病変が外科的切除されなかった場合は、臨床診察および同側乳房の画像検査を6・12・24か月後に実施して経過を観察すべきである。24か月経過後に変化がなければ、通常の年齢別乳房検診に戻ってよい。 | 強い合意 |
| 6b. 良性葉状腫瘍を切除済みの患者は、年齢に応じた通常の乳がん検診を継続するよう推奨される。 | 強い合意 |
線維上皮性病変(FEL)の診断に関して病理医間で差があるため、臨床医は施設内の病理医と報告基準について相談すべき。施設によっては線維腺腫と線維上皮性病変(FEL)を区別せず報告することがあり、その場合でも臨床的・病理学的に良性葉状腫瘍が疑われる病変は切除すべきとされる。
2025.10.24
運営委員会は、各疾患群に関する専門知識と経験(過去の学術論文やアメリカ乳腺外科学会委員会での活動実績など)を有する専門家を選出し、それぞれの分野に対応するエキスパートパネルを編成しました。
各パネルには、乳腺画像学会からの代表者も含まれています。
これらの専門家は、文献レビューに積極的に参加し、運営委員会およびコンサルタントの監督のもと、4つの乳腺良性疾患の領域(前回お示しさせていただいた表を参照ください)間で一貫性を保ちながら初期ガイドライン文案を作成しました。
ガイドライン策定は、まず文献の系統的レビューから始まり、文献要約表として整理されました。
その後、前述の臨床質問に基づき、初期のガイドライン文案が作成されました。
最終的なガイドライン文(Table 1・2)および診療アルゴリズム(Figure 1・2)**は、エキスパートパネル、SG、そしてコンセンサスパネルによって承認されました。
ガイドライン作成に関与したすべてのメンバーは、ASBrSの利益相反(COI)開示書を提出し、学会の利益相反方針に従うことに同意しました。
| 項目 | 合意レベル |
|---|---|
1. 一般的コメント(General overall comments) |
|
| 1a. 手術で間質異型(stromal atypia)を伴う線維腺腫(FA)と診断された患者には、生涯にわたる乳がんリスクが上昇していないことを説明すべきである。他の乳がんリスク因子を除けば、薬剤による予防や高リスクであるとするカウンセリングは不要である。 | 強い合意 |
| 1b. 細胞型・複合型・若年型のFAは、標準的なFAと同様に管理すべきであり、推奨は変わらない。 | 強い合意 |
| 1c. 妊娠中または将来的に妊娠を希望する女性でFAが診断された場合、典型的なFAとして管理すべきである。ただし、持続的または急速な増大がある場合は再評価および再生検が望ましい。 | 強い合意 |
2.経皮的治療 |
|
| 2a. 症候性で(何らかの症状があって)、生検により診断されたFAに対しては、腫瘤径が2.0cm未満であれば凍結療法(cryoablation)を検討してよい。施術者は十分な超音波技術と凍結治療の経験を有することが前提。 | 合意 |
| 2b. 同様に、2.0cm未満の症候性FAに対しては吸引式生検装置による切除(vacuum-assisted excision)も検討可能である。施術者が十分な技術と経験を有する場合に限り、術後に完全切除を画像で確認すべき。 | 合意 |
3. 画像診断 |
|
| 3a. 組織的な生検で確定したFAでは、追加の画像検査は不要。年齢に応じた通常の検診を行えばよい。 | 強い合意 |
4. 外科的切除の適応 |
|
| 4a. 生検で確定した一致例のFAに対して定型的切除は推奨されない。 | 強い合意 |
| 4b. 患者の希望または症状に基づいて切除を検討してよい。 | 合意 |
| 4c. 臨床的に明らかな増大がある場合は切除すべきである。 | 合意 |
| 4d. 腫瘤径が4〜6cmを超える場合は切除すべきである。 | 強い合意 |
|
4e. 画像診断医により「不一致(discordant)」と判断されたFAは切除すべきである。 |
強い合意 |
| 4f. 内在性または隣接する異型(atypia)を伴うFAは切除すべきである。 | 該当なし(NA) |
| 4g. 両側多発で画像上良性と判断されるFAは通常、切除を要しない。 | 強い合意 |
5. 手術手技 |
|
| 5a. 生検確定FAを切除する場合、切断(transection)や細断(morcellation)を避け、完全摘出を行うことが推奨される。 | 強い合意 |
| 5b. 切除法の局在化(localization)に関しては、特定の方法が他より優れているとは限らない。 | 強い合意 |
| 5c. 切開部位は整容性、授乳機能、乳頭皮膚感覚を考慮して決定すべきである。 | 強い合意 |
| 5d. 切除時は、腫瘤被膜を確認するまで触診を継続し、過剰切除や変形を避けるべきである。 | 強い合意 |
| 5e. 小児例では乳腺芽および乳頭・乳輪複合体を温存し、損傷を避けるべきである。 | 強い合意 |
6. 非手術的管理 |
|
| 6a. FAに対して推奨される薬物療法は現在存在しない。 | 強い合意 |
7. フォローアップ |
|
| 7a. 生検で確定した一致例FAでは、追加の画像フォローは不要であり、通常の年齢別検診に戻ってよい。 | 強い合意 |
| 7b. 生検確定FAが増大傾向を示すか、4〜6cmに達した場合は再診して切除を検討する。 | 強い合意 |
| 7c. 両側多発で画像上良性と判断されるFAでは、追加フォローアップ不要。通常の年齢別検診を継続。 | 強い合意 |
2025.10.24
先日、乳腺の良性疾患、特に線維腺腫や良性の葉状腫瘍を中心に、その取扱いについてのガイドラインが米国で出されました。我々医師にとっても重要な指標になります。できるだけ皆さんにもわかりやすいように長くなりますが、全文を訳してみたいと思います。
American Society of Breast Surgeons and Society of Breast Imaging 2025 Guidelines for the Management of Benign Breast Fibroepithelial Lesions Breast Imaging 2025 Guidelines for the Management of Benign Breast Fibroepithelial Lesions JAMA Surg Published Online: October 22, 2025 doi: 10.1001/jamasurg.2025.4392
米国では2025年に、30万件を超える新たな乳がん症例が診断されると推定されています。しかしそれよりももっと多くの女性が、医療的あるいは外科的な処置を必要とすることの多い良性の乳腺疾患を発見され、診断されています。マンモグラフィ検診の広範な普及や、近年ではトモシンセシス(3Dマンモグラフィ)が検診に日常的に導入されるようになったことにより、針を刺して乳腺の組織の一部を採取して検査する経皮的コア針生検(core needle biopsy)の件数も増加しています。
良性乳腺疾患とされる病態は非常に多くみられるにもかかわらず、これらの疾患の管理に関するガイドラインはほとんど存在しません。良性乳腺疾患は乳腺に影響を及ぼす幅広い病態を含んでおり、その治療方針は時代とともに変化しています。
かつては当たり前に切除されていた多くの病変が、現在では経過観察されるようになってきました。
感染性・炎症性疾患についてはより複雑化しており、その管理戦略をめぐって議論が続いています。
良性乳腺疾患の管理に関して一定のコンセンサスを作成するため、アメリカ乳腺外科学会は、乳腺画像学会(SBI)と協力して、すでに証明された医学的な事実に基づき、専門家の合意形成によって策定された管理ガイドラインを作成するための運営委員会を設立しました。
この良性乳腺疾患ガイドラインの策定は、アメリカ乳腺外科学会の使命――すなわち「乳腺疾患患者のケアにおいて卓越性を追求する外科医の代弁者として、乳腺外科の実践を継続的に改善する」という目的――に沿った取り組みです。
運営委員会は、ガイドライン策定が特に求められる4つの分野を特定しました:
1 良性線維上皮性病変(benign fibroepithelial lesions; FELs)
2 感染性・炎症性病変
3 異型増殖性病変/高リスク病変(proliferative lesions with atypia or high-risk lesions)
4 その他の良性乳腺病変
これら4領域はいずれも、管理法が限られている・議論が多い・過去10年間で大きく変化した良性乳腺疾患をほぼ包含しています。
本ガイドラインで示される「良性線維上皮性病変の管理」には、線維腺腫(fibroadenoma)および良性葉状腫瘍(benign phyllodes tumor; BPT)が含まれます。
なお、本ガイドラインにおいて「線維腺腫」とは、特に明記がない場合、上皮性の異型を伴わない線維腺腫を指します。(注:これに関しては以前から”複雑型”と分類されている、線維腺腫、あるいはその周囲の乳腺上皮細胞に異型があるもの、これを除く、と定義しているようだ。異型というのは、乳がんが発生されるといわれる乳腺上皮細胞と呼ばれる細胞に、顕微鏡で見たときに例えば大小不同があったり、あるいは細胞の構築に乱れがあったり、あまり正常な状況では見られないものが認められた際に使われる用語である。もちろん癌細胞はすべて異型な細胞である。型にはまらないという意味にとっていただいてもいい。)
アメリカ乳腺外科学会(ASBrS)の特別運営委員会(ad hoc Steering Group; SG)は、乳腺画像学会(SBI)と協力して、新たに開発された良性乳腺疾患(Benign Breast Disease: BBD)管理ガイドラインの策定・執筆・公表を監督しました。
これらのガイドラインは、以下の医療従事者を対象としています:一般外科医および乳腺外科の専門医 放射線科医 高度実践看護師(advanced practice practitioners) 産婦人科医 内科・家庭医などのプライマリケア医 研修医・専攻医
特別運営委員会は、各疾患の有病率・臨床的特徴・治療的特徴に基づいて、良性疾患の分類群(補足資料 )を定めました。本ガイドラインの範囲は、診断後の良性疾患の管理に限定されており、診断に至るまでの過程は対象外です。本ガイドラインの前提として、画像検査結果と生検による病理診断が一致している場合において、良性乳腺疾患全般での整合性が確保されているものとします。(注:つまり画像上もそこから行われた診断過程において、憂いなく、間違いなく、良性疾患と診断されたものについての取り扱いについて述べている、と前振りしているのです。一部でもがんの合併が疑われるようなものは外しているということです。)
また、「年齢に応じたスクリーニング(age-appropriate screening)」とは、年齢およびその他の乳がんリスク因子を考慮した検診を意味します。
良性線維上皮性病変(benign fibroepithelial lesions; FELs)に関しては、高品質な無作為化試験(RCT)が限られており、エビデンスの質が不十分であるため、文献の「グレーディング(エビデンスレベル付与)」は行いませんでした。無作為化臨床試験、メタアナリシス、系統的レビューを優先しましたが、それらが存在しない場合はコホート研究や症例対照研究も採用しました。ただし、10年以上前の研究や症例数100例未満の研究は除外しました。
多くの推奨項目は、非無作為化研究や専門家の意見・解釈に基づいています。したがって、同分野の他の専門家が本ガイドラインの一部推奨に異議を唱える可能性があることを認識しています。
最終的な推奨の強度は、専門家パネル内での合意度および一般から寄せられたコメントによって決定されました。
分類 | 見出し(Header) |
|---|---|
感染・炎症性病変 | 肉芽腫性乳腺炎 Granulomatous mastitis (GM) 授乳期乳腺炎 Lactational mastitis (LM) いわゆる乳輪下膿瘍(乳管の扁平上皮化成に伴う乳管周囲炎)Periductal mastitis with squamous metaplasia of lactiferous ducts (PDMSMOLD) |
良性 線維上皮性病変 | 線維腺腫 Fibroadenomas Fibroepithelial lesions (FEL) 良性葉状腫瘍 Benign phyllodes tumors (BPT) |
異型を伴う、ハイリスクな増殖性病変 | Atypical ductal hyperplasia (ADH) Lobular neoplasia: atypical lobular hyperplasia (ALH) Lobular carcinoma in situ (LCIS)(all types) Flat epithelial atypia (FEA) 注:癌にまでは至らないものの、リスクが高い病理学的な変化を指しています。これに関しては専門の人間でなければ分からないと思います。ここでは解説しないでおきます。 |
| その他の病変 | 乳頭腫 Papillomas Radial scars/sclerotic disorders Pseudoangiomatous stromal hyperplasia (PASH) 硬化性腺症 Sclerosing Adenosis 注:これもそう診断されたことのある方でなければ参考にはならないと思います。 |
続きます。
2025.10.16
乳がん術後 ホルモン剤としてアロマターゼ阻害剤(アリミデックス🄬 アロマシン🄬 フェマーラ🄬)を使用している方では、この薬のエストロゲンを抑える作用のために、どうしても避けられない副作用として骨粗しょう症があります。骨粗しょう症の予防は「骨折してから」では遅い、という考え方からお薬を使われている場合も多いと思います。(よく誤解されますが、タモキシフェンは、女性ホルモンの乳腺に対する作用は押さえますが、骨と子宮に対する作用はむしろ増幅するので、骨粗しょう症はむしろ予防的に働きます。)
アメリカ・ニューメキシコ大学のE.マイケル・ルイエッキ医師はこう話します。
「現在の多くのガイドラインでは、骨折リスクが低い人には生活習慣の改善を、高い人には骨吸収を抑える薬を、そして非常に高い人には骨を作る薬を使うという考え方です。しかし、骨密度(Tスコア)が−2.5より上で、まだ骨折していない女性でも、薬による予防を検討してよい場合があります。」
ちなみにTスコアとはTスコアとは、あなたの骨密度が「健康な若い成人(おおむね20〜30歳女性)」の平均値と比べてどのくらい低いかを示す数値です。つまり、若いころの平均的な骨の強さを基準に、どのくらい骨が弱くなっているかを表しています。参考までに計算方法を示しますが、病院で骨塩定量を調べてもらった際に計算してもらうのが簡単です。
Tスコア =(あなたの骨密度 − 若年成人の平均骨密度) ÷ 若年成人の標準偏差(SD)
0 … 若い成人と同じ骨密度
−1 … やや減っている(約10〜12%骨密度が低下)
−2.5 … 約25〜30%ほど骨密度が減少している → このあたりから、骨折リスクが急激に上昇します。
閉経期の女性では、ホルモンの変化で骨の密度が急激に低下しやすくなります。骨が弱くなり、内部の構造が壊れると、元に戻すことは難しくなるため、早い段階での予防が重要です。つまり骨粗しょう症は進むと巻き戻しをすることは基本的はできない。つまり一方通行なのです。
ニュージーランド・オークランド大学のイアン・リード医師とアメリカ・オレゴン骨粗しょう症センターのマイケル・マックラング医師は、「単に骨密度(Tスコア)だけで治療を決めるのではなく、年齢・骨折歴・人種などを含めた全体的なリスクで判断すべきだ」と述べています。
骨密度が−2.5以下なら骨粗しょう症ですが、−2.5から−1.0の間は「骨量減少(オステオペニア)」と呼ばれます。この範囲の人は個人差が大きく、骨折リスクはさまざまです。実際には、骨粗しょう症と診断されている方よりも、骨量減少の範囲に収まる方が人数が圧倒的に多いため、骨折の大部分はこの群で起きています。
多くの骨粗しょう症治療薬は、骨粗しょう症の「予防」にも承認されています。
閉経後の女性で、ほてりなどの更年期症状がある場合は、ホルモン補充療法(エストロゲンなど)が予防に有効とされます。
ただし、エストロゲンは乳がんの発症や再発リスクを高める可能性があるため、乳がん既往者や高リスクの方には注意が必要です。アメリカ臨床内分泌学会(AACE)のガイドラインでも、「骨粗しょう症以外に適応がない場合は、エストロゲン以外の薬を優先すべき」とされています。
代表的なビスホスホネート系薬剤には、アレンドロネート・リセドロネート・イバンドロネート・ゾレドロン酸(ゾレドロネート)*などがあります。これらは骨の分解を抑え、骨折を防ぐ薬です。
ゾレドロン酸は特に人気があり、年1回または5年に1回と投与間隔が長く、効果が5年以上続くことが分かっています。(ただわが国ではゾレドロン酸は骨粗しょう症に保険適応がありません。○悪性腫瘍による高カルシウム血症 ○多発性骨髄腫による骨病変及び固形癌骨転移による骨病変が適応です)
ただし、ビスホスホネートにはまれに「あごの骨が壊死する」重大な副作用(顎骨壊死)が報告されています。歯の抜歯や感染がきっかけで起こることがあるため、治療前には歯科のチェックが推奨されます。
また食道アカラジアによって胃炎や食道炎が起こったり、背部痛、筋肉痛、関節痛、骨痛などの副作用もあります。
閉経直後で更年期症状がある女性ではホルモン療法が向くこともありますが、乳がんが心配な人やホルモン治療が合わない人では、ビスホスホネート系薬が第一選択となります。
骨折リスクがそれほど高くない人では、服薬による利益が小さく、副作用や費用を考慮して「薬を使わない選択」も妥当です。治療を受けるかどうかは、患者本人の意向を尊重して決めるのが理想です。
骨を「作る」タイプの薬(テリパラチド、アバロパラチド、ロモソズマブ)は、骨折リスクが非常に高い人に使われます。これらは治療目的でのみ承認されており、予防目的では使われていません。
2025.10.03
乳がんの治療で使われるホルモン療法(タモキシフェンなど)には副作用として「膣の乾燥や痛み」といった症状が起こることがあります。ご高齢女性では起こることが、ホルモンを抑制することで若い時から発生してしまうのです。つらい方も多いと思います。高齢女性はこれに対して膣に使うエストロゲン薬があり、とても有効なのですが、乳がんの方では「乳がんが再発するのでは?」という不安から、多くの患者さんが使用を避けています。
今回、65歳以上の乳がん患者さん約1万8千人を対象に調べた結果、膣エストロゲンを使った人の方が、むしろ生存率が高かったことが分かりました。乳がんで亡くなる確率も下がっていました。特に長く使用した人ほど効果が見られました。思っていたのと逆で驚きの結果です。
この研究から、膣エストロゲンは「乳がんを悪化させないどころか、生存率を改善する可能性がある」と示されました。生存率を高めるために、わざわざ使うこともないかもしれませんが、それで困っておられる方が使用をためらう理由はありません。症状がつらいのに不安で使っていない方には、新しい安心材料になるかもしれません。

米国アリゾナ大学 医学部・公衆衛生学部・がんセンターにおいて、2010〜2017年に乳がんと診断された65歳以上の女性18,620人を対象に、SEER-MHOSという米国の大規模データベースを用いた後ろ向き研究が行われました。そのうち膣エストロゲンを使用した患者(800人)と使用しなかった患者(17,820人)を比較し、主に「全生存率(全ての死因を含む)」を、次に「乳がん特異的生存率(乳がんによる死亡に限る)」を評価しました。年齢、人種、がんの進行度、治療内容などを考慮に入れた解析を行いました。
結果:膣エストロゲンを使用した患者では、使用しなかった患者に比べて 全生存率(HR=0.56, p<0.0001)も乳がん特異的生存率(HR=0.53, p=0.014)も有意に改善していました。特に7年以上使用した患者では、より大きな全生存率の改善が見られました(HR=0.01, p<0.0001)。
ホルモン受容体陽性乳がんに限定した解析でも、膣エストロゲン使用群は全生存率が有意に改善していました(HR=0.62, p=0.0007)。
結論:膣エストロゲンを使用した乳がん患者は、生存率が改善しており、少なくとも悪化はしていませんでした。この結果は「膣局所エストロゲンは再発リスクを高めない」という新しい考え方を支持し、患者の生活の質を改善できる可能性がある重要な臨床的意味を持ちます。


今回の結果は、ハザード比で0.56という驚異的な結果です。
これは乳がんによる死亡を半分近くまで抑制していることになります。これだけを理由に使用を考える方もいておかしくないレベルです。
ただ私はこの結果を膣剤の使用だけが原因ではないのではないか、と考えます。少なくともパートナーと良好な関係がなければ、危険なのではないか、と考えられている現状でそれを押し切ってエストロゲン膣剤を使用される女性はいないはずです。まずパートナーとの良好な関係があり、生活も充実しているからそういう動機づけがある。加えて、そういった女性なら、乳がんだけではなく、食生活や、運動など、身の回りの健康的な生活まで配慮している可能性が高い。こうしたことが驚くほどの差になってでているのでは、と考えます。先の人種による乳がん死亡率の違いの話題と同じ視線ですね。こうした数字には目に見えない違いが潜んでいる、あれです。
たとえ乳がんになられても、前向きに健康な生活に向き合い、努力する、ご自身の幸せを追求する姿勢をあきらめない。
おそらくそれこそが寿命を延ばす最大の理由になるように思います。
2025.10.03
以前から、米国アフリカ系の祖先をもつ方ではトリプルネガティブの乳がんが異常に多く発生することが分かっていました。
何らかの遺伝的な異常ではないか、生まれつき持っている遺伝子の異常が原因ではないか、と考えられてきましたが、どの遺伝子が原因なのかは同定されていません。最近これに関する研究結果が発表されました。
米国のしかもブラックと呼ばれる人種の方の話で関係ない、と思う方もおられるかもしれませんが、内容が非常に示唆に富むものだったので、紹介します。

研究の背景:トリプルネガティブ乳がん(ホルモン受容体やHER2が陰性の乳がん)は、特にアフリカ系アメリカ人女性で発症率が高いことが知られています。長年「人種によってがん細胞の遺伝的な特徴が違うのではないか?」という疑問がありました。
研究の方法:米国ロズウェルパークがんセンターの研究チームは、アフリカ系アメリカ人の女性462人のトリプルネガティブ乳がんについて、がん組織の遺伝子解析(エクソーム解析・RNA解析)を行い、他の人種の患者と比べました。
主な結果:結果として、がん細胞に後から起こる遺伝子変化(体細胞変異)については、人種間で大きな違いは見られませんでした。
TP53遺伝子の異常が非常に多い:アフリカ系アメリカ人女性の95%にTP53という遺伝子の変異があり、これは従来考えられていたより高率でした。(TP53遺伝子はがん抑制遺伝子です。癌を抑制する遺伝子が壊れることでも、癌は発生しやすくなります。) 乳がんの発生にはPIK3CAという遺伝子も重要ですが、この変異は少数であることが分かりました。
最終的に発症に関わる2つの道筋があることが判明しました。
若い人に多い「DNA修復の不具合によるタイプ」
高齢や肥満に関連する「加齢や生活習慣に関わるタイプ」
この発見から、トリプルネガティブ乳がんは「若い女性だけの病気ではなく、肥満や加齢も関係する場合がある」ことが分かりました。さらに遺伝子の特徴によって患者をいくつかのタイプに分けられる可能性があり、今後は免疫療法や分子標的治療などのより効果的な治療につながることが期待されています。
まとめ(ポイント):アフリカ系女性でトリプルネガティブ乳がんが多いのは「がん細胞の遺伝子の違い」ではなく、他の要因(社会的環境など)が関与している可能性が高い。


非常にセンシティブな問題なので、明言を避けていますが、アフリカ系の先祖を持たれている方ではトリプルネガティブ乳がんを発生させる明確な遺伝的な素因があるのではなく、その後の生活習慣にその原因がある可能性がある、と結論付けています。
その代表的な要素が肥満です。こうした生活習慣によりもたらされた後天的な要素のほうが大きいと述べているのです。
乳がんはたしかに遺伝の要素が大きいがんです。しかしそれだけではない。
たとえば乳がんの自己チェックを米国では学校で教えていますが、それは”高等”教育の現場です。
高校生にしか講義がないのであれば、中学校で教育から離れ、仕事に就いた方では乳腺の自己チェックの基礎的な考え方を身につけ、習慣づけを行うチャンスがなかった可能性があります。まして両親も高等教育を受けておらず、子供も受けられなかったとすれば、なおさらです。生活習慣が、乳がんによる死亡率に影響を与えている可能性は否定できません。
がんの発生、そして予後、それを考える際にはこうした隠れた要素も無視できないことが分かります。
以前、日本人は乳がんの発生が非常に少ない、しかしハワイに住んでいる日本人には米国にオリジンがある方と変わらず乳がんが発生する。なぜだろう、日本人はみそ、豆腐、など大量に大豆製品を取っている、大豆に含まれるイソフラボンが乳がんにいいのではないか、そう考えられた時期がありました。
しかしそれから40年ほど経過して、日本人の乳がん発生率はすさまじい勢いで増加して、すでに9人に1人とほぼ欧米に追い付きました。
40年で全く食生活が変わり、欧米化したからだ。そうでしょうか?
もう欧米と変わらない、ということはもう食生活もまったく欧米と一緒になったということですか?
それならばなぜ欧米で日本食がブームなのですか?日本に来られた外国の方が日本での食事が楽しいのはなぜですか?自国と違うからではないですか?
取れる作物も異なるし、気候も違うので、食事内容を全くほかの環境の違う国と同じにすることはむしろ大変難しいことです。40年でそれを完全に変化させ、ほかの国と同じにする、その理由もありません。
乳がんが急激に増加している理由、だから食事だけではないのです。そんな単純なものではない。
見直せるところから見直す。そういう身近なところから対策していくことが重要な気がします。できることからやっていく、それで十分なのではないでしょうか。
2025.09.25
このブログを読んでいただいている方には、何度も乳腺自己チェックの必要性についてお話をしてきたと思います。ブログで読んでいただけた方、本を読んでくださった方もおられるかもしれません。
私は乳腺の自己チェックをする、しない、ではなく、習慣にしていただきたい、と主張してきました。しっかり歯磨きをされる習慣を持っておられる方のほうが、定期的に歯科受診されています。横断歩道を渡るときにきちんと左右確認される習慣を守っておられる方のほうが、信号もよく守られる。
乳腺の自己チェックも同じ。きちんと自己チェックをされていれば自然と検診も受けられる。
そして正しい自己チェックの習慣をきちんと身につけられたなら、それを娘さん、妹、姪御さん、大切な人に伝えてください、とお願いしてきました。

今回 ピンクリボンで、自己チェックについて講演することになりました。
直接私が身振り手振り、口頭でも指導できることになっています。
幸いネット参加可能となっています。日本国中どこでも参加可能です。
ただし事前登録が必要とのことでしたので、もし参加希望の方がおられましたら利用してください。
また私のところに検診に来られている方でも、娘がいるのですが、遠方なので、と言われる方がおられます。そうした方も是非この機会に利用していただければ幸いです。
事前参加登録のQRコードが小さかったので、別に載せておきます。
リンク先は https://forms.gle/DVtmgPeMw4UZdkgZ6 とのことです。
利用してください。
会場に来られる方には、特注サイズの自己チェック用ビー玉を無料配布します。この機会に手に入れてください(用意していた分がなくなったら申し訳ありません)。ビー玉がなくなっても、当日にはビー玉付録の自己チェックの本を販売していますので、それをご購入していただくことも可能です。
アクリエ姫路は姫路駅から歩いてすぐですので、公的機関を使っても簡単に行けます。


それではみなさんに会えるのを楽しみにしています。
この機会に乳腺の自己チェックをぜひ始めてください。
2025.09.22

先日 尾道で乳腺の自己チェックについて講演させていただきました。
このブログを読んでおられる方で先に言えよ、と思われた方はすいません。次回10月4日にアクリエ姫路でしゃべりますので、よかったら参加してください。
私はその公演でも、また10月4日にも乳腺の自己チェックの必要性を繰り返し述べてきました。もちろんこのブログの中でもです。
理由はいくらでもありますが、2つ挙げてみます。
1 乳がんの5割以上はいまでもご自身で気づかれることによって見つかっています。自分で見つけるのだとしても早期発見するに越したことはありません。工夫したり、正しく施行することでよりちいさなしこりに気付けるのなら努力すべきです。
2 現状のマンモグラフィ検診による死亡抑制効果は30%強しかありません。乳がん患者さんの6割以上の方はたとえ検診を受けられていたとしても亡くなっていることになります。その6割の方が、検診と検診の間で自己チェックしておられたら、もしかすると小さな段階で気づけたかもしれない。
では正しい自己チェックの方法とはどういうものですか、となり、それを様々な形でお話ししてきたわけです。
しかし、そう話をすると、必ず「ではもうマンモグラフィ検診なんて受けなくてもいっしょなんじゃないですか?」という疑問が出てきます。先日の講演の際にもそうした質問を受けました。
これ本当に会場で聞いていただけたら大変ありがたい質問になります。これに応えておくことが非常に重要だからです。
この疑問に対する私の回答は二つあります。


子供さんがおられる方は、子供さんが横断歩道を渡るときに、かならず右をみて、左をみて、もう一度右を見て渡りなさいと教えるはずです。
「お母さん、信号は青なのに、なんで見ないといけないの?」
聞かれたらこう答えるはずです。
「本当は見なくてもいいよね。でもね、不注意で信号で気が付かないまま走ってくる車や、アクセルとブレーキを踏み間違えてしまうご高齢の方の事故もあったりしているから、気をつけておかないといけないんだよ。」
この会話に際して、子供さんがこう言われたらどうですか?
「どうせ自分で見て判断して渡らなければいけないなら、信号なんてなくていいんじゃないの?」
これと同じですよね。自己チェックは必要です。でもだからといってマンモグラフィ検診がいらないことにもならないし、まして意味がないことはなりません。


二つ目の根拠を示します。
歯をきちんと毎食後に磨いて普段から気を付けておられる人。
適当に磨く方、さすがに全く磨かない方はおられないでしょうが。
この二人の方のうち、歯科を定期的に受診して、チェックもしてもらっている可能性が高いのはどちらの方でしょうか。
もちろん前者ですよね。
本来逆でもいいはずです。でもそうなっていません。普段から自分の健康に気を配っておられるから検診も受診されるのです。普段から自分の健康に関心がない方は、まず検診も受診されません。この二つは比例するのです。
私は、乳腺の自己チェックは、歯磨きと同じように母から娘に習慣として教育してもらいたい、教育するものだと思っています。そしてそうした習慣づけがしっかりできておられる方は、検診に行け、と言われなくても必要な年齢になったら自発的に行くようになる。
検診を受診してその際に医師から習慣づけをしてもらう。これは歯科受診させればきちんと歯を磨くようになることを期待しているのと同じです。痛い思いをして反省させれば磨くようになるかもしれませんが、それは親が望むことではないでしょう。
そもそも歯も磨かずに歯科受診される方をどう思いますか?
健康に関して、きちんと自己管理する。
その延長線上に検診や人間ドックがあります。
毎日の習慣と、年に1-2回受診する検診、どちらも大事ですが、私は前者なしの後者はありえない、と考えます。煙草を吸いながら肺がんを気にして肺がん検診を受けるようなものです。それが悪いとは言いませんが、検診を受けても肺がんにならないようにはできない。早期発見ができるだけです。まずは肺がんにならない努力をすべきです。それをせずに、早期発見のための努力は惜しまない、それはやらないよりやったほうがいいですが、そもそも矛盾しています。
自己チェックは必要です。それは普段から意識する健康管理の一つです。
マンモグラフィ検診もその延長線上として必要であり、どちらかをすればどちらかがいらなくなるものではそもそもないのです。
2025.08.22
さてリンパのがん、悪性リンパ腫の話を聞いて、どう思われたでしょうか?
いや私だったら再建しないな、そう思われた方もおられるかもしれません。
しかしこのデータ、かけているものがあると思うのです。インプラントは再建術だけで使われるのではない。豊胸術でも使われています。豊胸術を受けた方で、悪性リンパ腫を発生している方はどれくらいおられるのでしょうか。もしそれが比較して少ないのなら、乳がんの方はもともと刺激で悪性リンパ腫も発生しやすいだけなのではないでしょうか。
これについて、再建術でインプラントを入れている方、豊胸術でインプラントを入れている方の比較をした論文は実は存在しないのです。米国でも豊胸術を受けられた方の追跡データがもともと存在しないので、調査のしようがないのです。もちろん米国でも豊胸術は盛んにおこなわれており、再建術よりもよほど多く施行されている可能性が高い。しかももっと古くから行われている可能性がある。わが国でもそうです。再建術が保険適応にされる前から、美容整形で豊胸術は自費で行われてきました。
しかし皆さんは今の今まで悪性リンパ腫になる可能性が高まるという話を聞いたことがありますか?
非常に少ないのですが、これに関する論文を探してみました。
米国のデータではその1でも紹介した大規模な追跡調査によって、再建術後にインプラントによって引き起こされる悪性リンパ腫は、人口100万人あたり年間で10~15人程度発生していました。
50歳で乳がんになってその後80歳まで生きたとします。統計的には無茶苦茶な計算ですが、年間10人発生するなら30年で300人発生します。100万人で300人であれば1万人に3人になります。このように数値は見方によって異なってしまうので、比較をするには条件をそろえないといけません。
同じく米国のコルデイロ医師による報告ではざらざらタイプのインプラントを用いた乳がん再建術後のBIA-ALCL発症リスクは1/355人(0.311/1000人年, 95%CI 0.118-0.503)と報告されています。中央値11.5年の追跡で10例発症したそうです。
Cordeiro PG, Ghione P, Ni A, Hu Q, Ganesan N, Galasso N, et al. Risk of breast implant associated anaplastic large cell lymphoma (BIA-ALCL) in a cohort of 3546 women prospectively followed long term after reconstruction with textured breast implants. J Plast Reconstr Aesthet Surg. 2020 May;73(5):841-46.
これをその1で紹介したやり方で計算すれば1万人当たり3人になるので大体同じです。計算方法によってずいぶん多い印象に見えるものですね。
そしてインプラントを用いた豊胸術後のリンパ腫のBIA-ALCL発症リスクは1/2832~1/30,000と幅広く報告されています。ただしこれはざらざらタイプに限定されていないことに注意が必要です。もし最大限に見積もるのなら1/2832人となります。
Wang Y, Zhang Q, Tan Y, Lv W, Zhao C, Xiong M, et al. Current Progress in Breast Implant-Associated Anaplastic Large Cell Lymphoma. Front Oncol. 2021;11:785887.
豊胸術でインプラントを用いる方が、再建術で用いるよりも悪性リンパ腫の発生リスクは低いのではないか、と考えられます。
しかしテビス先生の発表では、BIA-ALCL患者の61.5%が豊胸術後、36.5%が再建術後だったとあります。もともと豊胸術でインプラントを入れている方の方が圧倒的に多いでしょうからこれは当たり前ですが、ただ皆さんが知らないだけで豊胸術の方でも悪性リンパ腫は発生していることは現実のようです。
Tevis SE, Hunt KK, Miranda RN, Lange C, Pinnix CC, Iyer S, et al. Breast Implant-associated Anaplastic Large Cell Lymphoma: A Prospective Series of 52 Patients. Ann Surg. 2022 Jan 1;275(1):e245-e49.
オイシ先生の論文によれば、インプラント関連ALCLは、低酸素性の腫瘍微小環境におけるリンパ増殖と悪性転換を促進する慢性炎症に起因すると考えられています。難しい話ですが、ただ単にインプラントが存在してリンパ球を刺激するだけでは発生しないのです。再建術後の血流が悪い環境下で免疫が刺激されることがリンパ球のがん化に影響しているという説があります。豊胸術では乳腺がまるまる残っていて、血流は全く問題ありません。再建術の際にはまず乳がんを直さないといけないので、乳腺そのものが切除されており、皮膚しかありません。おまけに腋窩のリンパ節も切除されたりして、インプラント周囲の環境の血流が悪くなっています。それががん化の舞台を作り出す、と考えられているのです。
Oishi N, Hundal T, Phillips JL, Dasari S, Hu G, Viswanatha DS, et al. Molecular profiling reveals a hypoxia signature in breast implant-associated anaplastic large cell lymphoma. Haematologica. 2021 Jun 1;106(6):1714-24.

乳腺外科の部長をしていた現役の時には、私もざらざらタイプのインプラントを使用してたくさんの乳がん患者さんに乳房再建を施行していました。幸い私はBIAーALCLを経験していませんが、これから発生するかもしれないことを考えて、それらの方の多くを今に至るまで定期的に検査をしています。
またインプラントは10年おきに入れ替えが必要です。もちろん入れ替えで対応する方も多いですが、入れ替えのタイミングで自家組織でインプラントを入れ替える手術を行って、最終の完成をさせることを勧めています。そうすればその後はリンパ腫のリスクがほぼなくなるからです。
それくらいなら最初から自家組織で再建すればよかったのではないですか?は誰でも考えますが、乳がんの手術に加えて、おなかにせよ、背中にせよ、正常な部分にメスを加えると、手術自体が非常に大きくなってしまいます。がんの手術においては、患者さんの負担を減らし、免疫能を落とさないようにすることは基本の基本です。たとえば手術時間を1分でも短く、出血量は1㏄でも少なく、と言われるのはそのためです。私はがんと同時に自家組織で再建することは負担が大きすぎると思っていて、いったんインプラントで再建しておいて、がん治療が落ち着いて、体力もしっかり戻ってくる5年目以降に自家組織で入れ替えるのが理にかなっていると考えています。
このようにリンパ腫の問題だけではなく、インプラントによる再建にはいろいろと複雑な選択肢があり、それに伴う問題があります。説明するのは本当に大変で、かつ理解が難しいと思います。
ただもし今のこの現状で外科部長をしていたとしても、そのままこの現状を話をした上で、患者さんに乳房再建を選択するかどうか、選んでいただくことをしているだろうと思います。自分が悲惨な悪性リンパ腫を経験していないからだ、と言われればそうですが、抗がん剤一つとってもその投与の副作用で患者さんがなくなることも0ではないのです。
患者さんには選択する権利があり、選択するのに必要な知識を得るために十分な説明を聞く権利があります。自分の判断を押し付けることが専門家の役割ではないからです。根気よく、「わかった」と言っていただけるまで説明し、納得した上で後悔のない選択をしていただく、そのことを目指すのが専門家の役割だと思っています。
ご予約専用ダイヤル
079-283-6103