2024.07.29
今回の話を始める前にまずは前提から。
一つ目の前提、乳がんは、手術で完全に切除することができれば治癒します。
乳がんで命を取られてしまうのは、転移を起こすから、と言い切って構いません。乳腺はすべて切除することはできますから、がんが乳腺から出て、切除することができない臓器、肺、肝臓、脳などに転移するから命を取られます。もちろんそこだけであれば切除できますが、がんがほかの臓器に転移を起こした場合に、まず1か所で済んでいません。血液やリンパの流れに乗って全身に広がっていることがほとんどです。ですから体から完全に取り除くことができず、最終的に命を取られます。
ですので転移を起こす前に切除に成功すれば治癒させることができるのです。それを目指すことを早期発見というのです。
逆に非浸潤性乳管癌(=DCIS)、ステージ0とされる乳がんがあります。このがんは理論的に転移しません。ですので切除によって完全治癒が期待できるとされます。診断が正しく、間違いなくDCISであったなら、その乳がんは手術によって完全に治癒し、転移や再発することはありません。その意味からは真の早期発見でもあります。
二つ目の前提は、一度乳がんに罹患され、治癒されている方であっても、対側の乳腺、温存して残った乳腺に、再び乳がんが発生することがあります。そしてその確率は、一度も乳がんに罹患したことのない方よりも高い。実際現在日本人女性の9人に1人、米国では8人に1人が乳がんに罹患されていますが、乳がんに一度罹患された方は、二次的に乳がんになられる確率が4人に1人まで上昇することがわかっています。
そしてここからが今回の本題であり、不思議なことなのですが、二回目に発症した乳がんは、なぜか最初に発生した乳がんより予後が悪いことがわかっています。同じような大きさで発見されても、すでにリンパ節に転移していたり、再発する傾向が高かったりする。
これを踏まえて今回の話を始めましょう。
******************************************
Giannakeas らがJAMA Oncology 誌に発表した、米国の最新の人口ベースのコホート研究の結果によると、片側乳がん患者が、対側乳腺に乳がんを発症すると乳がん関連死のリスクが増加することが明らかになりました。ここまではよくわかります。しかしこの研究では、両側乳房切除術を予防的に受けた患者では、たしかに二回目の乳がんを発症するリスクが減少することは示されましたが、なぜか死亡率そのものには影響を与えませんでした。
Giannakeas V, Lim DW, Narod SA: Bilateral Mastectomy and Breast Cancer Mortality. JAMA Oncol 2024.
乳がんになったら両方の乳腺を切除してしまわれる方がおられることを、驚かれる方もいると思います。しかし片側だけ残してもかえって整容性が悪く、服装も気を使うとのことで、その後に対側に乳がんが発生する不安から、両方とも切除される方は米国では意外におられるのです。
ただこの研究結果、大変不思議な結果になっています。
というのも、対側に発生する乳がんは、それはそれでそこから転移する可能性のある新たな原発腫瘍であると一般的に考えられています。私も考えていました。
予防的に対側の乳房を切除すれば、もちろん対側に乳がんが発生する頻度は下がります。
しかしそのことによってその患者さんが乳がんによって死亡する確率が変わらなかったのです。
意味が分かりませんよね。
これは大変奇妙なことです。対側乳がん後の死亡率増加が、全く独立した新しい乳がんからの転移によるものであるならば、両側乳房切除術が有益でなければなりません。
研究者らは米国の登録データベースを使用して、2000年から2019年の間にステージ0からIIIの片側浸潤性乳がん(n = 564,062、85.3%)または乳管内癌(n = 97,208、14.7%)と診断された661,270人の患者(平均年齢= 58.7歳)を特定しました。
この集団のほぼ4分の3は最初に乳房温存手術を受け、残りの患者は片側(23.4%)または両側(6.0%)乳房切除術を受けました。
両側乳房切除術を受けた人の合計90.7%をマッチングさせ、同じサイズの3つの外科コホート(コホートとは同じ時期に同じ出来事を経験した人たちのグループという意味になります。実際の数 = 36,028)を確立することに成功しました。
この3つのコホート、つまり片方の乳腺に浸潤癌が発生し、温存手術を受けた方、全摘を受けた方、そして両方とも乳房を切除された方の3つのグループは、対側乳がんの発生、および乳がんによる死亡率について20年間追跡調査されました。データ分析は2023年10月から2024年2月の間に実施されました。

◆対側乳がんリスク
20年間の追跡期間中、乳房部分切除術、片側乳房切除術、両側乳房切除術を受けた患者で、それぞれ合計766例(コホートの2.1%)、728例(2.0%)、97例(0.3%)の対側乳がんが記録されました。
最初の原発腫瘍から対側乳がん発症までの経過期間の中央値は5.0年(範囲=2.3~8.6年)でした。
乳房部分切除群と片側乳房切除群を合わせた対側乳がんの年間リスクは0.3%、20年リスクは6.9%(95%信頼区間[CI] = 6.1%~7.9%)と報告しました。もちろん両側切除を受けられた方では対側乳癌はほぼ発生しません。
◆乳がんによる死亡率
15年時点で、乳房部分切除群と片側乳房切除群を合わせた乳がんの累積死亡率は、対側病変を発症した患者では32.1%、発症しなかった患者では14.5%でした。
対側病変を時間依存共変量として使用すると、乳がんによる死亡のハザード比は4.00(95% CI = 3.52~4.54)でした。これはもし乳がん術後、対側の乳がんをもし発症してしまうと、その後、乳がんによって死亡する確率が4倍になる、ということです。もちろんそれは元の乳がんからの転移、新しい乳がんからの転移、その両方によります。
乳房部分切除、片側乳房切除、両側乳房切除を受けた患者のうち、それぞれ合計3,077人(8.5%)、3,269人(9.1%)、3,062人(8.5%)が乳がん関連死を経験しました。乳がんによる20年間の累積死亡率は、乳房部分切除術後では16.3%、片側乳房切除術後では16.7%、両側乳房切除術後では16.7%でした。つまりこの3つのコホートで、対側乳癌の発生率には差があるにもかかわらず、結局として死亡する確率には全く差がなったのです。
「これらのデータに基づくと、乳がんの女性 1,000 人中 69 人が診断後 20 年以内に対側がんを発症すると予測されます」と研究者らは結論付けています。「対側乳がんを発症した後、研究対象者における死亡率は、対側がん発症時から追跡調査終了時まで 4 倍に増加しました。しかし、片側乳がんに対して両側乳房切除術を受けた患者は、片側手術を受けた患者と同等の死亡率でした。」
これは大変奇妙な現象です。なぜこんなことになるのでしょうか。
2024.07.28
このブログでも、2024年に発表された米国予防サービスタスクフォース(USPSTF)による最新の乳がん検診の勧めについて、何度も、それこそ何度も触れてきました。
・米国予防サービスタスクフォース(USPSTF)による最新の乳がん検診の勧め
・米国予防サービスタスクフォース(USPSTF)が乳癌検診に関する新しい草案勧告を発表しました
・米国予防サービスタスクフォースが乳癌検診に関する新しい草案勧告を発表しました(続)
・米国予防サービスタスクフォースが乳癌検診に関する新しい草案勧告を発表しました(続続)
これらは今までの乳がん検診をご存じの方からすれば、乳がん検診の開始年齢の推奨を50歳から40歳に引き下げただけに映ります。最新の推奨では繰り返しになりますが、「40 歳から 74 歳までの女性に 2 年に一度のマンモグラフィ検査を推奨しています」となります。
ただ推奨の文章や、内容を詳細に読み込んでいくと、年齢の引き下げに関することよりも、毎年よりも隔年(2年に1回の”方が”いい)と強調されていることに気が付きます。毎年受けることはむしろ”害”がある、という風に書かれているのです。この記載の影響が実は最近大きく問題になっているのです。
2024年7月15日のMEDPAGEの記事によれば、施行されたアンケート調査によって、検診に関する知識が深まると、40代の女性の多くがマンモグラフィ検査を控える傾向にあることが報告された。 調査対象となった女性の3分の1以上が、過剰診断、つまりマンモグラフィ検診の害についての情報を「驚くべきもの」と感じたようです。
「え!?害があるの?」と思われた方はもう一度、「米国予防サービスタスクフォース(USPSTF)による最新の乳がん検診の勧め」の記事を参考にしてください。
米国では、乳がん検診の開始を検討している方に対して、意思決定ツールというものが配布されています。このツールについて簡単に説明すると、もともと検診は自分の意思で受けるものであり、半年に1度だろうが、2年に1度だろうが、極端な話、一生受けないでいようが本人の勝手です。ただ受けようという意思をお持ちの方に、どのように受ければ最善なのか、ということを考えるのは意外に難しい問題です。毎週受けてください、それが一番安全です、なんて言われても困るでしょう。被ばくは問題にならないんですか?すぐにそういう疑問がわきます。
だからツールではまずその方の乳がんの罹患リスクを”計算”することから始めます。
残念ながらこうしたツールのほとんどは英語で書かれており、皆さんには敷居が高いかもしれません。たとえば比較的入力項目が少なくて、簡単に使用できる、米国の厚生労働省に相当するNIHが提供しているBreast Cancer Risk Assessment Tool: Online Calculator (The Gail Model) を紹介し、使ってみます。
たとえば
1 いままで乳がんを含めて、DCIS、LCISと診断されたことはない。そして何らかの理由で胸に放射線治療(胸部レントゲン写真は除く)を受けたことはない。
2 遺伝子検査でBRCA1 あるいは2、それ以外の異常も含めて指摘されたことはない。
3 48歳の日本人である。
4 今まで検診で所見ありとされ、生検を受けられたことがある。幸い癌ではなかった。
5 初経は11歳から
6 最初に出産したのは30歳のとき
7 お母さん、娘、姉妹に乳がんの方が一人だけおられる。
これで計算できます。
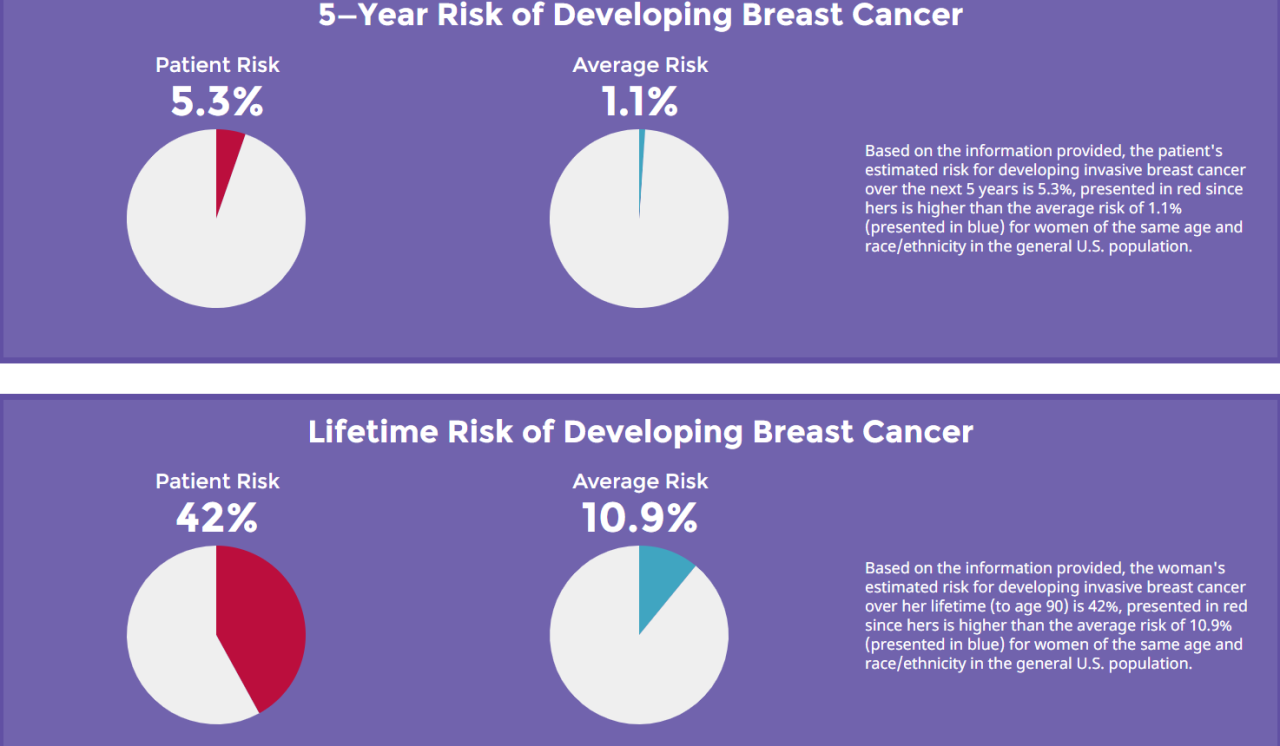
結果が上記になります。上の段の見方は、「これからの5年間で貴方が乳がんを罹患するリスク」です。貴方と同じ年齢の女性の平均は1.1%、しかし貴方自身は5.3%もあります。
人生全体で見たときのリスクが下段です。貴方と同じ年齢の女性の平均は10.9%、しかし貴方自身は42%もあります。
貴方は □ 平均よりも乳がんに罹患するリスクの高い方 になります。
同じようにして計算すれば、平均の方、平均より低い方、に分類されることになります。
そして米国予防サービスタスクフォースの推奨、40歳から隔年のマンモグラフィの施行、は平均か、それ以下のリスクとされた方への推奨となります。リスクの高い方へは、別の考え方をする必要があるのです。
またこれも以前に述べましたが、マンモグラフィ検査で、「高濃度乳腺である」と診断された方、75歳以上の方に関しては、この米国予防サービスタスクフォースの推奨は当てはまらない、とされています。
そう考えると、この40歳から74歳まで隔年でのマンモグラフィ検査、の推奨の対象に当てはまる方は意外と少ない、ということになりそうです。
しかしそれでも今回の推奨を読み込み、検診に関する知識が深まると、40代の女性の多くがマンモグラフィ検査を控える傾向にある、のです。
米国での全国オンライン調査によると、マンモグラフィ検査のメリットとデメリットに関する情報の提供を行うマンモグラフィ検査の意思決定支援ツールにより、平均リスクしかない40代女性では、マンモグラフィ検査を延期したいと考える方の割合は増加しました。実際には意思決定支援ツールを見る前は、39歳から49歳の女性の27%が検査を延期したいと考えていましたが、ツールで学習した後には38.5%に上昇しました。
また、調査では、意思決定支援ツールを見た後、現在の年齢でマンモグラフィ検査を受けることを望む女性が事前には67.6%であったのに、それが57.2%まで減少した。さらに開始を50歳まで待つことを望む女性が増えた(8.5%が18%に増えた)ことも明らかになりました。
どのような情報が彼女たちの見解を変えたのでしょう。
調査対象となった女性の37.4%が、意思決定支援ツール内の、過剰診断に関する情報に「驚いた」と答え、28.1%が医師から言われたことと違っていたと報告しています。
やはりこのツールで提供される、マンモグラフィ検診の”害”についての情報がこの傾向を生み出していることがわかります。過剰診断による害とは、貴方が乳がんでもないのに乳がんの疑いがあるとされる、あるいは乳がんがあるのに、ないとされることを含みます。それによって不必要な治療を受けるデメリットも含みます。意思決定支援ツールでは、過剰診断リスクがスクリーニングでがんとして発見された異常全体の割合(12~22%)として提示されています。これではその”害”に直面する頻度が、非常に高いように感じます。
しかし実際医は 絶対数、つまり検診を受けられた方全体でみれば、1,000人あたり1~3件に過ぎず、そうして提示された場合よりもリスクが高いと認識される可能性があると思われます。
今回の改正では、検診の対象範囲(年齢)が拡大されましたが、同時に情報提供によって、受診を自分から控える人が増えるという皮肉な結果につながっているようです。これでは本末転倒のように思います。
たとえば抗がん剤、それこそ目薬であっても、薬には必ず副作用があります。しかし薬は副作用のために使用するのではありません。効果のために使用するのです。効果が十分に伝わっていないのに、副作用の説明ばかりしてしまえば誰だって使用をためらいます。
隔年を毎年にすれば害、貴方が乳がんでもないのに乳がんの疑いがあるとされる、あるいは乳がんがあるのに、ないとされることを含みます。それによって不必要な治療を受ける、そういう機会が10%増えます。しかし隔年を毎年にすれば、乳がんによる死亡率が10%下がります。
そもそもこの数値を比べていることがナンセンスです。
白菜を市場に運びたい、でもあと1㎏が載せられない。ここで捨てるしかなくなる。
だから今馬車に乗せている金塊1㎏を捨てて行こう、みたいに聞こえます。
どちらにしても、主治医としっかり話し合って、自分なりの乳がん検診の在り方をしっかり把握して、受けていかれるようにしていただきたいものです。
まとめ
・米国で推奨されている乳がん検診は、隔年でのマンモグラフィ検査の実施です。しかしそれは乳がんの平均リスクの方を対象としており、平均以上のリスクのある方は含みません。加えて高濃度乳腺である方、40歳以下、74歳以上の方を含みません。
・たしかに検診にも害はあります。ただ害だけをみて判断することは間違いです。すべてはバランスによるものです。メリットデメリットをしっかり把握して、自分に最善の検診の在り方を考えていきましょう。
2024.07.19
メディケア(米国の保険制度)患者を対象とした遡及的研究によると、乳がんを患う高齢女性に対するホルモン療法を施行した場合、その後のその患者さんの認知症リスクの低減と関連していることが示唆されました。サウスカロライナ大学コロンビア校のチャオ・カイ博士らがJAMAネットワークオープンで報告しています。Cai C, Strickland K, Knudsen S, Tucker SB, Chidrala CS, Modugno F: Alzheimer Disease and Related Dementia Following Hormone-Modulating Therapy in Patients With Breast Cancer. JAMA Network Open 2024, 7(7):e2422493.
ホルモン療法を受けた乳がん患者は、ホルモン療法を受けなかった患者と比較して、平均12年間の追跡期間中に認知症のリスクが7%低かったとのこと。(HR 0.93、95%CI 0.88-0.98、P =0.005)しかしその効果は年齢によって反対の効果にもなっていたようです。
認知症のリスク低下は、65~69歳の乳がん患者群で最も顕著に認められました(HR 0.48、95% CI 0.43~0.53)。しかしこの関連性は加齢とともに減少しました。
80歳になると、ホルモン療法の使用は認知症リスクとの正の関連性に移行し(HR 1.40、95% CI 1.29~1.53)、90歳以降までその傾向が続きました。
またこの効果は人種によっても異なる結果になっており、ホルモン療法を受けた65~74歳の黒人乳がん患者では、相対リスクが24%減少しました(HR 0.76、95% CI 0.62~0.92)。同じ年齢層の白人乳がん患者では、相対リスクが11%減少しました(HR 0.89、95% CI 0.81~0.97)。
「ホルモン治療のような特定の治療法から、認知症リスクの低減という恩恵を受ける可能性のあるのは、特定の一群であり、全員には当てはまらない」と、Cai氏は語っています。「結果を最適化し、リスクを最小限に抑えるためには、患者の年齢や人種などの個人的要因を考慮するべきである。」

薬剤ごとの認知症への影響も、人種によって異なるようです。
65~74 歳の黒人女性の場合、アロマターゼ阻害剤の使用は、SERM(タモキシフェンなど)(HR 0.80、95% CI 0.57~1.11)よりもわずかに強い関連性を示しました(HR 0.73、95% CI 0.59~0.91)が、SERMに関する知見は有意ではなかった。
65~74 歳の白人女性では、SERMによりリスクが有意に減少しました(HR 0.81、95% CI 0.70~0.94)。
多くの乳がんはホルモン受容体陽性で、エストロゲン(女性ホルモン)ががん細胞の増殖に及ぼす影響を阻止するためにホルモン療法で治療されています。ホルモン療法は乳がんの生存率を高める可能性があるが、認知機能の低下との関連も報告されていると、カイ氏と共著者らは指摘しました。過去の研究では、ホルモン療法との関連はないという反対の結果もあり、逆にホン論文のようにホルモン療法による予防効果があるとするもの、または認知症リスクの増加が示されたなど、一定した結果は出ていませんでした。
話はそう単純ではないようです。
Chai氏らは、がん登録データとメディケア請求を組み合わせた監視、疫学、SEERとメディケアの連携データベースを使用して、2007年から2009年の間に新たに乳がんと診断された65歳以上の女性を特定してかいせきしました。認知症の既往歴がある患者や、乳がんの診断前にホルモン調節療法を受けていた患者は除外しています。彼らは、がん治療のためにホルモン療法を受けた女性と受けなかった女性を比較し、乳がんの診断から2019年末まで最低10年間追跡調査しました。ホルモン療法を受けているかどうか、の定義に関しては乳がんの初回診断から3年以内に、タモキシフェンなどのSERM、アロマターゼ阻害剤、ゾラデックスなどの選択的エストロゲン受容体分解薬など、少なくとも1種類のホルモン調節薬の投与を開始したことと定義しました。合計で 18,808 人の女性がこの研究に含まれ、そのうち 65.7% がホルモン療法を受けていました。最も一般的な年齢層は 75 ~ 79 歳で、女性の 80% 以上が白人、約 7% が黒人でした。ほとんどの女性 (76.1%) がアロマターゼ阻害剤によるホルモン療法を開始していました。
衝撃的な内容だったので、ここで紹介しました。ホルモン療法と認知症リスクには何らかの関係がありそうではあるのですが、実際の治療で認知症リスク改善を狙って投与することは時期尚早でしょう。そもそも人種ごとに差があると書いているのに、アジア系の人の調査は行われていません。
ホルモン剤が投与されていない乳がん患者さんはトリプルネガティブ乳がんが、HER2エンリッチ乳がん症例のはずです。投与されているひとはルミナールタイプです。こうした乳がんのサブタイプごとの発生リスクと遺伝の関係は絶対ではありませんが、0ではありません。ホルモン剤が直接認知症を抑えているのではなくて、ルミナールタイプの乳がんになりやすい遺伝子を持った方が認知症になりにくいのかもしれません。またホルモン剤を投与されている方は投与されていない方よりもどうしても医療機関を受診する機会が増えます。そのため高血圧や、糖尿病など、認知症リスクに直結する疾患が早く見つかり、治療されているからなのかもしれません。
ホルモン療法と認知症に関するさまざまな研究は以前から行われているようです。しかしこういうテーマで研究を行う場合、遡及的研究(いままでの過去の症例をさかのぼって検索すること)設計では、なかなか思うような結果には至らないことが多いのが現実です。
あえて認知症の発症に研究対象を絞って、健康な人を、ホルモン剤を投与した群としなかった群に分けて調査する必要があります。それだと本来ホルモン剤が必要でもなんでもない人に何年も投与することになってしまうことを考えると、真の答えを見つけるのは難しいかもしれません。
2024.07.17
「私はきちんと2年に1回 マンモグラフィ検診を受けているから大丈夫」
以前にも触れましたが、米国予防サービス特別委員会 (USPSTF) による乳がんスクリーニングガイドラインでは、すべての女性が40歳から隔年で乳がんの検査を受けることを推奨しています。これはしかしBグレードの推奨です。Aではありません。隔年、あるいは毎年でもマンモグラフィによる乳がん検診を受ければ、乳がん死は抑制されるという確実な証拠があります。これは間違いない。ならばなぜBなのでしょうか。
その勧告は、科学的証拠に基づいて評価され、勧告の強度はAからDまでの等級で示されます。A等級は高い推奨度を示し、D等級は効果がないか、または害があるという証拠があることを示します。
最新のガイドラインでは、開始年齢が引き下げられ、40歳から隔年で乳がんの検査を受けることを推奨していますが、これはBグレードの推奨とされ、純利益が中程度である、または中程度の効果があるという高い確実性があることを意味しています。なぜAではないのでしょうか。
もし本当に”きちんと2年に1回 マンモグラフィ検診を受けているから大丈夫”であるのなら、それを1年に1回、そして半年に1回、3か月に1回としていけば、ほぼ100%大丈夫、でなければなりません。
しかし少なくとも1年に1回で北斗さんや、小林麻央さんの例があるように100%大丈夫ではありません。早期発見できないこともある。では半年、3か月に1回ではどうでしょうか?
これも前述しましたが、米国予防サービス特別委員会 (USPSTF) による乳がんスクリーニングガイドラインはMonticcioloをはじめとする研究者らによる、がん介入・監視モデリングネットワーク(CISNET)の2023年乳がんスクリーニング結果に基づいて定められました。研究者らは乳がん検診の利点とリスクを以下の4つの異なるシナリオで比較しました。
結論として、Monticcioloは、40歳から79歳の女性を対象にデジタルマンモグラフィまたはトモシンセシスによる年1回のスクリーニング(つまりシナリオ4)により死亡率が41.7%減少することを発見しました。一方、シナリオ1では25.4%減少し、シナリオ2では30.0%減少しました。
つまり2年に1回を、1年に1回にしても乳がんで死亡する確率を10%下げるだけだったのです。
私の医療圏では140名の方が亡くなっていると言いました。2年に1回の検診を1年に1回の検診に倍に増やしても、140名が120名になるだけなのです。それが小さいとは言いません。ただ医療コストは単純に倍になるので、それに見合わないとは言えると思います。
ましてやこれでは「私はきちんと2年に1回 マンモグラフィ検診を受けているから大丈夫」とは言えないのではないでしょうか。推奨グレードAとはとても言えないでしょう。

例えば毎年歯科受診をしている方は、受診していない方よりも齲歯は少ない。
学校以外に塾に通う子は通っていない子より成績がいい傾向がある。
ただそれは歯科医が何かしたからよりも、そういう人の方が、日常での意識が高く、しっかり気を付けて歯磨きをするからではないのでしょうか?年1回の歯科医の処置よりもその方が大きいのではないか。
塾も、週に1-2時間受けている講義で何を習っているかよりも、そういう意識がある子の方が普段から勉強する傾向が高いから成績が良くなるのではないでしょうか。
隔年のマンモグラフィ検診で、乳がんを全例確実に早期で発見できるから乳がん死の抑制効果が出ているのではない。検診を受けておられる方は、普段から乳腺に気を付けて自己検診をしており、気になったらすぐに施設を受診する心構えができているから、乳がん死が抑制できているのではないか。
ちなみに検診を定期的に受けておられる方が、それでも検診ではなく、ご自分で腫瘤に気づいて乳がんを発見してしまう場合、これを中間期乳がんと言います。
Orsiniらの研究によれば、定期的に検診を受けている方で、検診と検診との中間期に自覚症状で発見される乳がん症例は全発見症例の28.9%にのぼり、その腫瘍の平均サイズは18mmでした。
Orsini L, Czene K, Humphreys K: Random effects models of tumour growth for investigating interval breast cancer. Statistics in Medicine 2024.
逆に定期検診を受けないから乳がん死に至るのではなく、定期検診を受けない方は、乳腺に関心がないから進行するまで乳がんを放置していて死に至るのではないか。
私が経験した過去3年以内に検診歴のない自己発見乳がん症例1541例における腫瘍サイズは触診では24.0mm、病理切片上では23.4mmでした。同じ自分で触って乳がんを発見したとしても、検診を定期的に受けられている方ではサイズを小さく見つける傾向があります。検診を受けられない方は進行して見つかる、それは常識ともいえるがそれは検診が直接的に影響しているだけではないのかもしれません。
早期発見にこだわらないとすれば、もともと乳がんは検診を受けなくても自己チェックで発見できます。だとすれば隔年施行されるだけの乳がん検診の精度をあげることよりも、乳がん検診の受診率をあげることの方が乳がん死の抑制効果はよほど大きい可能性が高いといえます。さらにそれによって自己検診をさせる動機付けを行い、日常の乳がんに対する意識を高めることで乳がん死を抑制することに貢献する効果も無視できないのではないでしょうか。
われわれ検診クリニックは、来られた患者さんの乳がんを早期発見することはもちろん必須です。
でもおなじくらいの努力が、受診される方の動機づけと、その方の日常の意識改革、自己検診の教育に向けられていなければならないのではないか、そう思います。
2024.07.17
最近 投稿が滞っていました。少しつれつれ雑談をしてみようと思います。
今年も日本乳がん学会総会が仙台で開催されました。
3日間の日程ですが、雨にたたられっぱなしで学会会場にこもっているしかない、という状況は、勉強熱心な学会会員の皆様には何ともないかもしれませんが、せっかく仙台まで来たのだからと思っている私のような人間には少し残念なお天気になりました。学会会場のそばに伊達政宗の銅像がある青葉城があったりするのですが、散歩をして上がるのにも雨は降る、蒸す、足はべたべたする、メガネは濡れる曇る、でさんざんです。
日程の間を縫って、レンタカーを借りて松島まで行ってみることにしました。
夕方の風景を期待してワイパーを振りながら松島につきましたが、しっかり雨。ガスっていて遠景は期待できません。それでもと思い、遊覧船乗り場についてみたら16時が最終とのこと、着いたのは16時半でしたからあきらめざるを得ませんでした。調べてから行けよ、声が聞こえます。夏は日が長いので時間間隔がくるっていたようです。運航しているかなと。まあ考えてみれば当たり前の時間ですね。
仕方なく、車でうろうろして少しでも長めのいいところを探しました。

日本三景の一つですが、こういう細かな島が点在している風景は瀬戸内の風景を見慣れている私には普通のことです。松島を松島たらしめているものは、やはり自生している?、もしかしたら植えたのかもしれませんが、島を植えつくすように茂っている立派な松の森なのだな、とわかりました。
日本画を好む人たちにはたまらない風景なのだろうと思います。
雨ですが、日本画どころか水墨画ならそれもまたよしなのでしょうか。
思い出されるのは東北の大震災です。津波はここまで来ていたはずですが、松が損傷を受けたようには見えませんでした。複雑に入り組んだ島や、それこそ生い茂る木々が防波堤の役割を果たしたらしく、大きな被害にはならなかった、と聞きました。古刹はもともとそうした土地を選び、立てられているからこそ古刹なのであって、そういう何百年も経たような古い建物がたくさん残っているような土地はもともと災害にも強いのだろうな、と思いました。
さてそろそろ乳がんの話
基本的に我が国の医療は皆保険制度によって成り立っています。しかし検診は原則自費です。最近では企業や自治体が補助をしてくださって、無料で受けられる検診もありますが、その意味からは皆さんは決して安くない金額を払って検診を受けられているわけです。
その意味からは来院される方の“ニーズ”に私は答えなければなりません。とはいえ来院される方のニーズは人それぞれであり、また誤解されている方もおられます。ただ我々は乳腺クリニックです、比較的ニーズは絞られます。
乳腺クリニックを検診目的で受診される方の究極のニーズは自らの乳がん死を無くすこと、です。
検診は何回受けても、どれくらいの頻度で受けられたとしても、乳がんにならないようにはできません。執筆時2024年に開催されている日本乳癌学会総会では現在年間約9万人の日本人女性が新たに乳がんと診断され、うち約1万4,000人が乳がんで亡くなっていると提示されました。約15%が亡くなっている計算になります。
私の施設の医療圏は100万人なので、私以外の先生も含めて、日本の人口の1億人のうちの100万人、100分の1を担当しています。日本で年間9万人が乳がんになられるのなら私の地域では900人が乳がんに罹患されている計算になります。そしてその15%である140人の乳がんで亡くなってしまう運命を変えることが役割になります。
しかし私は乳がんを治療する立場にない。治療はできません。検診を生業にしています。
誤解を恐れずに言いますが、その患者さんの乳がん死を無くす、という大きな目標においては、基幹病院などの治療施設よりもわれわれの方が役割は大きいと思っています。
乳がんの診断がつき、治療施設を受診した時には実はその乳がんが死に至らず、治癒するかどうかもう確率的に決まっています。治療施設はガイドラインに決められた内容を決められた手順通りに行っています。したがって治療施設が最大限の努力をしているのは、標準治療に劣ることのないようにはすることであり、それが当然ではありますが、それによって治癒する確率は決まっています。保険診療の範囲は限定しているのでなおさらです。
もしかすると現在行われている臨床試験の中には将来標準治療になるような、現状を変えてしまうような治療法や薬剤があるかもしれません。しかしそれは誰にもわかりません。もしかすると標準治療よりも劣るかもしれない。保険適応でもありません。
その方を乳がんで亡くなる運命から救う、それには治癒可能な早期で発見するしかないのです。幸い現状でも浸潤性乳がんのステージIの5年生存率は99%に達しています。我々の地域の年間900人乳がん患者さんの全員が早期で発見される、それが達成できれば事実上ほぼ乳がん死は亡くなります。そしてそれができるのは、私のような最前線の検診施設なのです。
私たちは乳がんで亡くなる方を0にすることを目指して、一人でも多く早期発見し、治癒する段階で見つける努力を継続することが使命になります。具体的には目指すものは二つ、乳がん検診の受診率を100%とする。乳がん検診の早期発見の精度を100%とする。この二つでしょう。そしておそらく前者の乳がん検診の受診率をあげる、これがもっとも効果が大きい。
しかしそれが一番難しいことでもあります。
2024.06.05
ホルモン補充療法、それは主に女性ホルモン(エストロゲン)製剤ですが、それとプロゲステロン(黄体ホルモン剤、ピルと呼ばれることも多い薬剤です。)を長期間併用すると乳がんの発生率がわずかに上昇することが知られています。ただこれらの複合ホルモン避妊薬と 乳腺濃度の関連性に関するデータは限られています。
複合ホルモン避妊薬(ピル)を使用した閉経前女性と、使用しなかった閉経前女性、さらにその後乳がん を経験した閉経前女性を対象とした 3 つの症例対照研究の分析では、乳腺濃度の変化に有意差はありませんでした。
16,608 人の閉経後女性を対象とした Women's Health Initiative ランダム化試験では、1 年および 2 年の追跡調査後にエストロゲン&プロゲスチン投与グループで 乳腺濃度の増加が見られました。
プラセボ(偽薬)投与にランダムに割り当てられた女性と比較して、ホルモン補充療法を受けたグループの女性は 1 年目にもともとの乳腺濃度からの増加の平均値が最も大きく(6%上昇)、たいしてプラセボ グループでは0.9% 減少していました。2 年目には増加が小さくなりました(4.9%増加、たいしてプラセボグループでは0.8% 減少)。
閉経後エストロゲン&プロゲスチン投与による介入 (PEPI) 試験では、結合型馬エストロゲンとプロゲスチンの組み合わせを投与するようランダムに割り当てられた 3 つの女性グループすべてで、プラセボ(偽薬)グループと比較して 12 か月間で 乳腺濃度が統計的に有意に増加 (3%~5%) しました。
エストロゲン・プロゲスチン併用療法を使用した閉経後女性 5212 名を対象とした観察集団コホート研究では、非使用者と比較して乳腺濃度が増加し、ホルモン補充療法の継続によってその増加が維持されました。ホルモン補充療法による乳腺濃度の増加は、最初の 1 年間と現在の使用者で最も顕著であり、ホルモン補充療法の中止後にはもともとの乳腺濃度まで減少しました。
さまざまなホルモン補充療法を比較した前向き研究では、エストロゲン・プロゲスチンを持続的に投与した群では、周期的エストロゲン・プロゲスチン投与群およびエストロゲンのみ投与群と比較して 乳腺濃度が有意に増加したことが示されました ( P < .001)。またそれはプロゲスチン投与量にも関連していました。
Fornili らは、ホルモン補充療法、乳腺濃度、および 乳がんのリスクの関連性はホルモン受容体陽性乳がんに限ったものであると報告しています。
Fornili M, Perduca V, Fournier A, Jerolon A, Boutron-Ruault MC, Maskarinec G, et al. Association between menopausal hormone therapy, mammographic density and breast cancer risk: results from the E3N cohort study. Breast Cancer Res. 2021; 23: 47.
ホルモン補充療法とホルモン受容体陰性乳がんの間には関連性は見つかりませんでした。ホルモン補充療法を現在使用している人と使用したことがない人を比較した乳がんの調整済みのリスク(オッズ比)は 1.67 (95% CI、1.04-2.68) でした。(これはホルモン補充療法を現在使用しておられる方は、していない方と比較してホルモンに感受性のある乳がんの発生するリスクが1.67倍であるという意味になります)。この研究によると、乳腺濃度の増加は、ホルモン感受性陽性乳がんのリスク増加に対するホルモン補充療法の影響の最大 50%を占めていました。(ホルモン感受性乳がんが発生した場合の半分まで乳腺濃度の上昇も認められていた、ということになります。)
まとめ
・更年期障害や、骨粗鬆などで、ホルモン補充療法を受けられておられる女性も多いと思いますが、これらのホルモン剤はとくにエストロゲンとプロゲステロンを併用した際に(もともと複合されている製剤もあります)、乳腺濃度を上昇させるようです。
・またそれはある程度ホルモン感受性のある乳がんのリスクを増加させるという結果があります。
・これはそういったホルモン補充療法をするな、という意味ではありません。乳がん検診をしっかり受けるなど、注意しておきましょうという意味に解釈してください。
ホルモン剤以外で乳腺濃度に影響を与える可能性がある薬剤はありますか?
たとえば糖尿病などでインスリン投与を受けておられる場合、血液中のインスリン濃度が高く保たれていると、ヒトがん細胞株および正常乳房組織の細胞増殖を刺激することがわかっています。(筆者注:これは不思議でもなんでもありません。ミルクは母親が十分に栄養を取ることで分泌されます。母親が飢餓状態であればミルクは止まります。これは授乳経験のある方は皆さんご存じです。常に母親の栄養状態が優先なのです。母親がしっかり栄養を取った、自分が必要とする以上に取った、高血糖になる、インシュリンが分泌される、血液中のインシュリン濃度が上昇する、ミルクが出る。こういう経路が存在するのです。したがってインシュリンは乳腺を本来刺激します。)
685,644 人の女性からなるデンマークの食事、がん、健康コホートでは、インスリンレベルの上昇が乳腺の濃度の増加と関連していました。観察研究および分析では、インスリン、アンドロゲン、およびエストロゲンの循環レベルが低下すれば乳房組織の増殖を抑制することとなる。そしてメトホルミンが閉経後女性の乳がんのリスクを低下させることが示されました。(メトホルミンはインシュリンとは別の経路を使って血糖値を落とす糖尿病の治療薬です。)
2 型糖尿病(インシュリン投与を受けておられない糖尿病)の閉経後女性を対象とした 2 つの小規模観察研究では、メトホルミンの使用と乳腺濃度の間に逆の相関関係が確認されたが、この関係は統計的に有意ではありませんでした。
サプリメントと乳腺濃度の関連性については、限られた観察データしか入手できません。ビタミンB12、C、E、Dとの関連性を検証した研究では、一定の結果は得られず、矛盾する結果が出ています。ビタミンDは、インスリン様成長因子とエストロゲンの増殖経路を阻害し、その受容体を減少させて乳腺濃度を減少させる可能性がありますが、こうした研究は現状決定的な結果を得られていません。
まとめ
・インシュリンの血中濃度が高く維持される状況は乳腺濃度の上昇に関与するようです。糖尿病性乳腺症という病態が存在しており、これは糖尿病、特にインシュリンを使用されるような1型糖尿病の方によく経験されますが、乳腺濃度が強く上昇していることが特徴です。
・ただ糖尿病の方も含め、適切な投与が行われていれば高インシュリン血糖は起こりようがありません。もちろん一般の方も同じです。
・むしろ肥満につながる食事、間食を好んで常になにか口にしているなど、常時血糖値が高いままとなっているような生活習慣の方がよくないと考えるべきでしょう。
皆さんは乳腺の濃度が高いことが乳がんの独立した危険因子であることを認識する必要があります。しかし乳房組織の密度が高いだけで乳がんが必ず発生するわけではありません。大部分の女性には乳がんは発症しないので過度に心配する必要はありません。
乳腺の高濃度はマンモグラフィーの感度を低下させるため、十分な情報を得た上で(ブレストアウェアネス)、意思決定のために補足的な乳腺の検査、超音波検査やMRIなど乳がん検診のリスクと利点についてカウンセリングを受ける必要があるでしょう。
喫煙を避け、正常な BMI(肥満指数) を維持するよう頑張りましょう。
飲酒による乳腺濃度の増加、そして乳がんのリスクの増加についてもカウンセリングを受け、アルコール摂取を制限するようにアドバイスをうける必要があります。
運動と食事は 乳腺の濃度に直接影響を及ぼさないように見えますが、週に最低 150 分の有酸素運動を組み込んだ運動プログラムを開始し、心血管疾患と乳がんのリスクを軽減する地中海式ダイエットを採用するようにカウンセリングを受ける必要があります。
ホルモン補充療法は乳腺濃度を増加させ、それがマンモグラフィーの感度をさらに低下させる可能性があることを認識しておきましょう。しかしホルモン補充療法を終了、あるいは中止すると乳腺濃度はもとに戻りますので安心してください。
今までの結果を表にまとめました。
上向きの矢印は効果が増加することを示し、下向きの矢印は効果が減少することを示し、二重の水平矢印は効果がないことを示します。
| ライフスタイル要因 | 乳腺濃度への影響 | 乳がんリスクへの影響 |
|---|---|---|
| アルコール摂取 | ↑ | ↑ |
| 地中海ダイエット | ↔ | ↓ |
| 適度な運動 | ↔ | ↓ |
| 喫煙 | ↓ | ↑ |
| BMIの上昇 | ↓ | ↑ |
| 更年期ホルモン療法 | ↑ | ↑ |
2024.06.02
食事性脂肪が乳腺の濃度に及ぼす影響に関するデータは、主に観察研究から得られたもので、現状では確定しているとはいいがたく、一貫性がありません。230人の若者を無作為に低脂肪食に割り当てた追跡調査では、グループ間で乳腺濃度に変化はありませんでした。しかし、1508人の女性を対象としたミネソタ乳がん家族コホート研究では、飽和脂肪と乳製品の摂取が閉経前女性の乳腺濃度の減少と関連していました。
地中海式ダイエットと、乳腺濃度を下げ、乳がんの発生率を低下させるのではないか、とその役割が調査されています。
424 人の女性を対象とした横断的研究では、地中海式ダイエットの摂取と 乳腺濃度の間に逆相関が示されました。
食事、身体活動、マンモグラフィー (DAMA) 試験では、424 人の閉経後女性が 4 つの治療介入 (食事、身体活動、食事と身体活動、およびコントロール) のうちの 1 つに無作為に割り当てられ、乳腺濃度の変化が評価されました。食事介入は、糖負荷が低く飽和脂肪酸レベルが低い植物ベースの食品で構成されていました。食事介入グループと身体活動介入グループの両方で、コントロールと比較して乳房密度の割合がわずかに低下しました。
欧州がんと栄養に関する前向き調査 (EPIC) フィレンツェ縦断研究では、炭水化物摂取量が多くグリセミック負荷が高い食事が 乳腺濃度の増加と関連していることがわかりました。
高血糖が高インスリン血症を引き起こし、インスリン受容体の活性化とインスリン様成長因子の増加を招き、これがエストロゲンと相乗的に作用して乳腺上皮の増殖を引き起こし、乳腺濃度の増加につながります。こうした影響が関与している可能性が考えられます。
まとめ
血糖値が高く維持される食事はインシュリンの分泌を促します。インシュリンはエストロゲンと相乗作用して乳腺濃度を上昇させるように働きます。
そのことを考えれば、高血糖につながる糖分の多い食事は避け、適度に運動を行う、これは常識的な生活態度ですが、それが乳腺濃度を下げることにつながります。
一部の疫学研究ではカフェイン摂取により乳がんのリスクが減少すると示唆されていますが、カフェイン摂取と乳腺濃度に対するその役割に関する研究は限られており、一貫性がありません。
看護師健康研究および看護師健康研究のコホートのデータによると、閉経前女性ではカフェイン摂取と乳腺濃度に関連はなかったが、カフェイン抜きコーヒーを1日2杯以上摂取すると乳腺濃度が増加することが示されました(p=0.03)。
閉経後女性では、カフェイン抜きコーヒーの摂取量とコーヒーの総摂取量の両方が乳房密度の割合と逆相関していることが認められました(p=0.04)。
これらのデータは、マンモグラフィーの日付より前に質問票に記入した4130人のがんのない女性から推定されました。カフェインはエストロゲン代謝を変化させ、血中エストロゲン濃度を低下させる可能性があり、カフェインには乳腺濃度を低下させる可能性のある抗酸化作用があるとされています。しかしカフェイン摂取が乳腺濃度に及ぼす影響を明確に定義するには、さらなる研究が必要です。
まとめ
・カフェインは過度に接種しなければ少なくとも悪影響はなさそうです。ただ乳腺濃度を下げる効果を期待して過度に摂取することも現状は勧められません。また砂糖を入れて飲まれれば先の血糖の問題に関係して悪影響が発生しそうです。何事も適度適量なのでしょう。
さまざまな研究で、身体活動と乳腺濃度の潜在的な関連性を評価しようと試みられてきました。
5,703人のデンマーク人女性を対象とした前向きコホートでは、身体活動と乳腺濃度の関連性は認められませんでした。
アルバータ州の身体活動と乳がん予防(ALPHA)試験では、有酸素運動がベースラインの乳腺濃度に影響を与えるかどうかを評価するために、320人の閉経後女性を運動群(週5日、45分)として介入する、そして介入しない対照群に1年間ランダムに割り当てました。この研究では、運動をすることで乳がんそのものの発生リスクは下がっていることがわかりましたが、乳腺濃度そのものにはグループ間で有意な変化は見られなかったことがわかりました。
DAMA試験では、身体活動介入群にランダムに割り当てられた女性で、対照群と比較して乳腺濃度が中程度に減少したことが示されました。
2012 年に発表された大規模なシステマティックレビューでは、このテーマを扱った 20 件の研究を分析および比較することで、身体活動と 乳腺濃度の関係を評価しました。結論としては、身体活動と乳腺濃度の関連性を示す説得力のある証拠はないというものでした。
乳腺濃度に対する有酸素運動の効果の欠如は、身体活動が乳房の脂肪部分にのみ影響し、線維腺領域には影響しないという事実によって説明できます。現在のデータに基づくと、こうした有酸素運動などの適度の身体活動は乳がんのリスクを低下させますが、そのメカニズムは乳腺濃度を下げることでは説明できない、別の理由を介している可能性があります。
まとめ
・有酸素運動を頑張れば、体脂肪が減り、乳がんに罹患するリスクは下がるようです。しかし脂肪は減っても乳腺組織そのものは減少することはなく、マンモグラフィ上での乳腺濃度は影響がないことがわかりました。
喫煙は、エストロゲン(女性ホルモン)の受容体部位において、エストロゲンを代謝し、活性が最小限となるように促進するため、抗エストロゲン効果があります。
さらに、喫煙は、(1)チトクロムP450酵素の誘導によるエストロゲンの肝臓代謝の増加と性ホルモン結合グロブリンレベルの上昇、および(2)アロマターゼ酵素活性の阻害によるバイオアベイラビリティの低下を通じて、エストロゲンレベルの低下をもたらします。(難しいですね。要は女性ホルモンを下げる働きをする、ということです。喫煙はやはり女性らしさの大敵ですね。)
いくつかの研究では、喫煙と乳腺の濃度の間には逆相関関係、つまり喫煙すればするほど乳腺の濃度が下がる、可能性があることが示されています。
各グループ203人の女性を対象とした症例対照研究では、喫煙者は非喫煙者と比較して、高リスクのマンモグラフィ実質パターンを示す可能性が低くでました(OR、0.37, 95%CI, 0.14-0.94)。
横断的コホート研究では、喫煙者である閉経前および閉経周辺期の女性は、非喫煙者と比較して乳腺濃度が7.2%低く、それは統計的に有意でした。閉経後女性の横断的研究の結果では、調整後平均乳房密度の割合は、喫煙者および元喫煙者( P = .003)の方が非喫煙者( P = .006)よりも有意に低いことが示されました。
42 5356 人の女性からなるデンマークの食事、がん、健康コホートでは、喫煙と乳腺濃度の関連性が最も強かったのは、16 歳未満で喫煙を開始し、1 日に少なくとも 15 本喫煙し、喫煙歴が少なくとも連続5 年以上あり、喫煙期間が少なくとも 30 年、最初の出産前に少なくとも 11 年間喫煙していた女性でした。43 23,456人の女性を対象とした大規模な人口ベースのコホート研究では、喫煙は乳房密度の割合と逆相関し、主に脂肪組織である密度の低い領域が広がる正相関していることがわかりました。これらの結果は、喫煙が乳房の脂肪組織を増加させ、乳腺の濃度を減少させるメカニズムを裏付けています。
喫煙は乳がんそのもののリスク増加と関連しているが、喫煙は乳腺脳濃度は下げるように働くように見えることから、喫煙関連の発がん物質は乳腺濃度の増加を伴わない経路を通じて乳がんのリスクを増大させる可能性があります。
まとめ
・驚きですが、喫煙は乳腺の濃度を落とす方向に働くようです。ただその有害物質によって乳がんそのものは減らないどころか増やす可能性もあるので、プラスマイナス0ですね。
出生体重が乳腺の濃度に及ぼす影響は明らかではありません。
閉経前女性では、乳腺の濃度と若年期のBMI上昇との間には曖昧な関連がありますが、閉経後女性でははっきりとBMIが上昇すれば、つまり肥満すれば乳腺の濃度は下がります。
BMIは、乳腺密度領域および乳腺密度率とは負の関連があり、乳腺の濃度は下がります。そして逆に非乳腺密度領域、つまり脂肪で満たされた部分は当然ですが正の関連があることがわかっています。
根治的乳腺切除手術(乳房全摘術)を受けた573人の女性を対象に、マンモグラフィーと磁気共鳴画像法を用いて乳房組織の特徴を評価した観察研究があります。その結果は、BMIが25以上の女性は乳腺濃度が低く(P < .0001)、乳腺実質である線維腺組織も少なかった(P < .0001)ものの、乳腺実質の背景に存在している乳腺以外の実質の増強(BPE)は高いとする結果が出ました(P = .005)。
BPEは乳腺実質の線維腺組織の血管分布に応じて変化し、女性ホルモンに敏感であるとされます。BPE の上昇は、太りすぎまたは肥満の女性の乳がんのリスクを高める潜在的なメカニズムを示している可能性があります。
肥満手術を受けた女性を対象とした複数のコホート研究では、乳腺密度が脂肪性乳腺の女性は体重減少とともに乳腺の濃度が増加する傾向が見られ、これは乳腺実質の線維腺組織の減少が比較的緩やかであるのに対し、乳房脂肪組織が全体的に減少したためである可能性があります。
乳腺密度が散在性や不均一高濃度の女性は、著しい体重減少があっても密度の有意な変化は見られませんでした。
BMIが上昇すれば乳腺濃度は相対的に下がります。しかしBMIの上昇はそれ単独で乳がんが発生する危険因子です。そのため乳腺濃度と肥満は、乳がんのリスクを上昇させる別の経路を持っている可能性があります。
まとめ
・この章は難しいです。肥満すれば皮下脂肪は当然増えます。乳腺実質のそのものが増えることも、インシュリンのところでも触れましたが事実でしょう。ただ実質が増えるよりも、脂肪の増殖の割合が高いため、結果として乳腺濃度は下がります。
・高い乳腺濃度は乳がんのリスクです。低い方が乳がんリスクは下がるのですが、脂肪によって置き換わることで乳腺濃度が下がっている場合はそうとも言えないようです。それはその分、乳腺組織そのものも刺激を受け、増加しているからであり、これを文中ではBPEの増加、と表現しています。
・結論として肥満することによって乳腺濃度を下がりますが、肝心の乳がんのリスクは下がりません。
雲行きが怪しくなってきました。結局どうしたら乳腺の濃度は下がるの?いまのところいい方法を教えてくれていないように思うんだけれど・・・・・・・・・・・・・その3へ続きます。
2024.06.01
乳がん検診において、マンモグラフィにおける乳房濃度は4段階に分けられます。特に高濃度乳腺や不均一高濃度乳腺とされた方は注意が必要とされます。乳腺の濃度はそれが上昇するにしたがって、乳がんの発生を増加させ、マンモグラフィの感度を相乗的に低下させる強力なリスク要因です。
また、がんでもないのにがんが疑わしいとされる偽陽性の発生がよく起こるため、精査をするように勧められたり、それによる追加検査、診断の遅れや、最終的には当てにならないとされて受診控えにつながるなど、医療費の増加にもつながります。
これらのことから、最近ではマンモグラフィ検診を受けられた方にはその乳腺濃度を通知することがほぼ義務付けられており、乳腺濃度に対する皆さんや医療提供者の関心の高まりにつながっています。しかし、乳がんの他のリスク要因とは異なり、乳腺の濃度は女性の生涯を通じて動的であり、修正可能です。
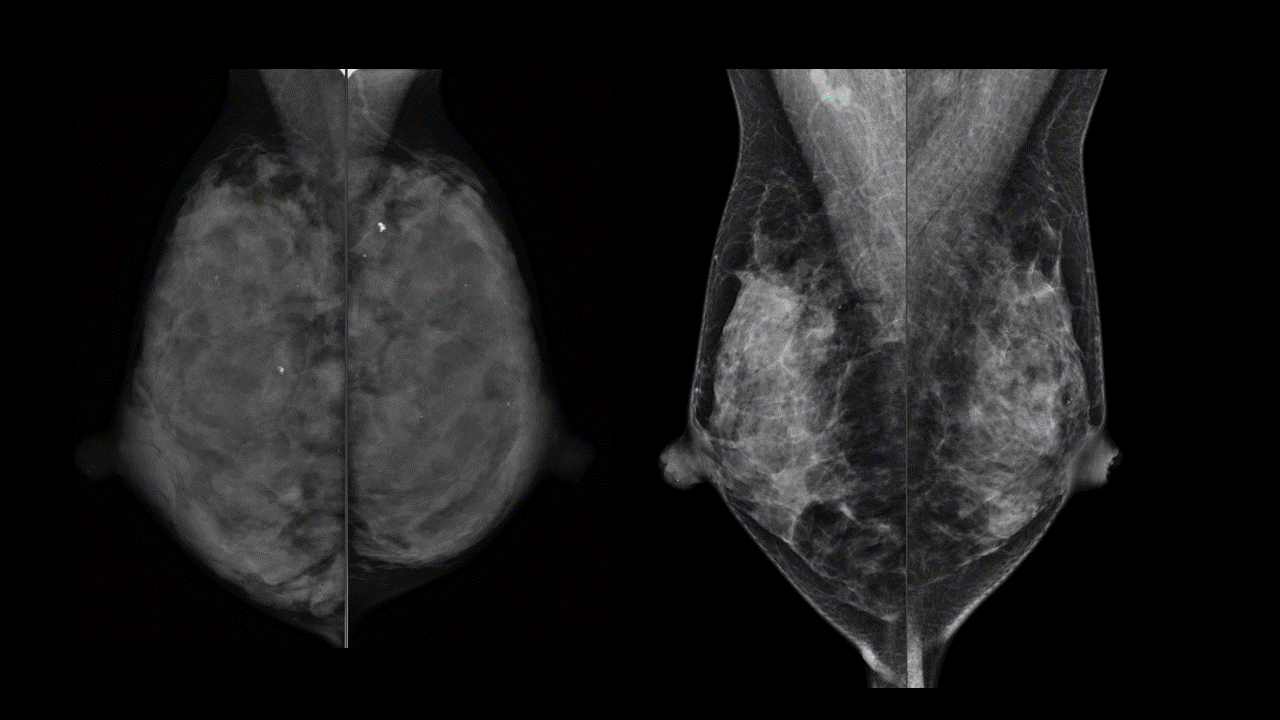
たとえばこのマンモグラフィは左右とも同じ型です。
左側は4年前に取られたもので、右側が現在です。乳腺のぎっしり詰まった感じがずいぶん痩せて、抜けてきたように思います。高濃度乳腺から不均一高濃度乳腺に変化しています。この方は左側の撮影時には33歳、右は38歳です。ここまでの変化は加齢だけでは起こりません。
この方はこの4年間で一人目のお子さんを授かり、1年近く完全母乳で授乳経験をされていました。
これまでもこのブログでは乳腺の濃度について何度も触れてきました。
高濃度乳腺とは ーAre You Dense?ー
”ブレスト・アウェアネス”という考え方
高濃度乳腺の乳がんリスクについて
”高濃度乳腺は乳がんリスクが高い”ことを知っていますか?
もしまだ読んでおられない方があればまずここから読まれることをお勧めします。
何度も触れてきたように、乳腺濃度は高ければ高いだけ、乳がんが発生するリスクが高まり、それでいてマンモグラフィ検診での発見が難しくなるため不利になります。
ただこの乳腺濃度は生涯一定ではなく、様々な要素で変化するのです。先に述べた授乳経験もその一つです。ただこれはだからと言ってそうするわけにはいきません。なにか現実的に実行可能な方法で乳腺濃度を”修正”できないか? それができるとする論文を見つけたので紹介させていただきます。
Lester SP, Kaur AS, Vegunta S. Association Between Lifestyle Changes, Mammographic Breast Density, and Breast Cancer. Oncologist. 2022; 27: 548-54.
Lester先生による論文を紐解きながら、これについて述べていきます。

女性の生涯を通じて乳房組織には大きな変化が起こります。思春期には乳腺が拡大・発達し、月経がはじまるとその周期に応じて増殖・退縮を繰り返します。授乳期には腺組織(ミルクを作る組織)と乳管(それを乳頭まで運ぶ管)が大きく変化します。閉経後は脂肪沈着や退縮が起こり、当然乳腺の濃度も変化します。
したがってその行動パターンによって乳腺濃度は生涯をかけて修正できる可能性があります。
乳腺の濃度が乳がんの独立した危険因子であるということは、大規模コホート研究、症例対照研究、および人口ベースの研究で証明されています。
乳腺濃度が高濃度乳腺である女性は、乳腺濃度が脂肪性乳腺の女性よりも、乳がんが発症する可能性が4 ~ 6 倍高くなります。乳がんの治療で使用される、女性ホルモンを抑制する薬剤、アロマターゼ阻害薬療法や選択的エストロゲン受容体遮断薬などを使用して、乳腺濃度を下げる治療をすれば乳がんそのもののリスクもさげることが知られていますが、これら薬剤を生涯にわたって継続的に使用することは現実的ではありません。
マンモグラフィ上で本来の正常な乳腺の組織と等密度である小さな乳房病変が、高濃度乳房組織によって隠されてしまう状況はしばしば発生しており、これが高濃度乳腺では乳がんの小腫瘤が発見できない大きな理由になります。つまりコントラストがなくなってしまうのです。(”雪原の雪ウサギ”、”闇夜の烏現象”です)
これにより、高濃度乳房の患者さんのマンモグラフィによる検診は大変難しくなります。小さな乳腺腫瘍が見落とされ、リンパ節転移を伴うようなより大きな腫瘍になるまで発見されなかったり、結果として生存率の低下につながる可能性があります。
マンモグラフィの全体的な感度(がんを見つける力、がんの症例が100例あればそのうち何例見つけられるか)は70 %~90%とされます。
脂肪性乳腺の乳房濃度の女性では感度は 80%~98% ですが、高濃度乳腺の乳房濃度の女性では感度が 30%~48% まで低下することがあります。しかし乳腺濃度を落とせばこうしたマスキング効果が減少し、マンモグラムの感度が向上し、早期診断が容易になります。
乳腺濃度は、授乳経験をすれば下がります。また乳がんで使われる女性ホルモンを抑制する薬を使えば下がります。しかしそれは現実的ではありません。
では実行可能な方法として、乳腺濃度を下げるにはどのような方法がある、とLester先生は言われるのでしょうか?
70,000人以上の参加者を対象とした複数の研究の体系的レビューによって、乳腺濃度の増加がアルコール摂取と関連していることが判明しました。これはなぜなのでしょうか。現在予想されているメカニズムは、アルコール摂取によりエストロゲン(女性ホルモン)産生とアロマターゼ酵素活性の増加が起こることが原因とされています。これによりアンドロゲンからエストロゲンへの末梢変換が促進され、エストロゲンレベルの上昇が引き起こされます。アルコールはインスリン成長因子とインスリン様成長因子も増加させます。これらは乳腺上皮細胞の増殖を引き起こし、エストロゲンと相乗的に作用して乳腺濃度の上昇につながります。
閉経前および閉経後の女性 424 名を対象とした研究では、1 日あたり 10 g を超えるアルコール摂取 (ワイン 250 mL あたり 25 g、ビール 300 mL あたり 12 g、蒸留酒 20 mL あたり 6.2 g) が乳腺濃度の上昇と関連していました。
閉経前および閉経後の女性 1508 名を対象としたミネソタ乳がん家族コホート研究では、1 日のアルコール摂取量が 3.9 g 以下の女性では、飲酒しない女性と比較して 乳腺濃度が上昇していました(p=0.08)。
乳房密度が高い女性 497 人と乳房密度が低い女性 288 人を対象とした研究では、大量飲酒者 (1 週間に 140 g 以上) に分類された女性と非飲酒者に分類された女性を比較したところ、飲酒量が増えるにつれて乳房密度が有意に上昇していました(p=0.09) (オッズ比 [OR]、2.1、95% CI、1.2-3.9、P=0.01)。
同様に、約 2000 人のヨーロッパ人女性を対象とした研究では、飲酒量と乳房密度の増加の間に正の相関関係が示されました(p=0.01)。
25 5356 人の女性を対象とした大規模コホート研究であるデンマークの食事、がん、および健康研究では、週に 7 杯以上飲む 20-29 歳の女性では乳腺の濃度が高く、特に飲み物が蒸留酒の場合にその傾向が強い傾向が見られました (OR、1.31、95% CI、1.00-1.72)。
ただ飲酒量の多い女性では、たとえば肥満しやすい、あるいは塩分摂取量が多いなど、他にも関連する要素が存在するので、アルコールそのものが乳腺濃度を上昇させているのか、については今後の研究を俟たないと結論は出ないと思います。
アルコールは乳がん、特にエストロゲン受容体陽性がんの既知の危険因子であり、アルコールは閉経前および閉経後の女性のMBDを増加させます。25、26 MBDの増加は発がん性のメカニズムである可能性があります。
まとめ1
・アルコール摂取は、乳腺濃度を上昇させる効果がある可能性があります。
・・・・・・・・・・・・・・・・・・・長くなりそうなので、第2回に続きます。
2024.05.09
以前にも ”米国予防サービスタスクフォース(USPSTF)が乳癌検診に関する新しい草案勧告を発表しました” という記事で、その内容を紹介しました。今回その総まとめのような形で患者さん向けのガイドラインが出ていましたので、私なりの考察を交えて(その部分はカッコで包みます)紹介します。
なおこの記事は、以前速報の形でこのブログで触れています。できたらそれも読んでいただけると幸いです。その時は論文でしたが、今回は一般向けに書き直されて出てきました。改めて紹介するのとともに、少し私の考察も加えたいと思います。

誰もが乳がんを早期に発見し、この病気で死なないためのより良い方法の出現を望んでいます。乳がん検診は、最も治癒が可能な時期、つまり早期にがんを発見できます。このガイドは、あなたとあなたの医療専門家が、検診を開始する年齢や検診の頻度など、乳がん検診の利点とリスクを理解するのに役立つことを目的としています。
このガイドは、BRCA遺伝子変異、胸部放射線治療歴、または乳がんの個人歴を持つ女性を対象としたものではありません。このような女性は、健康を維持する最善の方法について医療専門家に相談する必要があります。
乳がんは、米国女性のがんによる死亡原因の中で 2 番目に多いものです。毎年、約24万人が乳がんと診断され、約4万3千人の女性が乳がんにより死亡しています。
注目すべきことに、黒人女性は乳がんにかかる確率がほぼ同じであるにもかかわらず、白人女性よりも乳がんにより死亡する可能性が40%高い。黒人女性は若い年齢で悪性度の高いがんにかかることが多くなります。(筆者注:これは黒人という遺伝子的に異なる人種の問題が原因のように見えますが、実は白人の間でも、社会的弱者、つまり貧しい人であれば同じデータが出てきます。なぜ貧しいと同じように検診を受けていても死亡率が上がるのか、それも1.5倍近くまで。それは後で考察してみたいと考えています。)
・乳がん検診を受けることによって、乳がんをより治療が容易な段階で発見することが可能となり、クオリティオブライフ(生活の質)を落とすことなく、乳がんで死亡することから救うことができるようになります。
・マンモグラフィ検診は、デジタルマンモグラフィ、あるいはトモシンセシス(3Dマンモグラフィ)の形で行われます。両方とも乳がんの発見に有効です。
・乳がん検診は ”隔年”で受けることで、そのメリットを最大にし、デメリットを最小にすることができます。このデメリットとは、あなたが乳がんでもないのに乳がんの疑いがあるとされる、あるいは乳がんがあるのに、ないとされることを含みます。それによって不必要な治療を受けるデメリットも含みます。
・現代まで引き継がれている不平等によって、ある種の人種、そして社会的な弱者、貧しい人、そして田舎に住んでおられる方は、健康問題において比較的悪い結果が出て、乳がんでなくなる可能性がより高いことがわかっています。
・平等かつ適切な継続したケアと、乳がんと診断された女性の効果的な治療は、乳がん検診の命を救う目的におけるもっとも重要な必要事項であることを知る必要があるでしょう。
・どの検診方法が私に向いていますか?
・もしマンモグラフィで異常があった時にはなにが私に起こりますか?(その後どうすればいいでしょうか?)
・乳がん検診は何歳まで受けた方がいいですか?
・乳がんによる死亡を防ぐために、検診以外に何か気を付けることがありますか?
・私の家族歴や、他のリスク要因は、乳がん検診を受ける際にどのように影響しますか?
このガイダンスは、女性、および出生時に女性と割り当てられた人々を対象としています。(遺伝子的にXX染色体をもつ方と言ってもいいかもしれません)
そして、乳がんの兆候や症状がない、40歳から74歳までの方、乳がんを発症するリスクが平均とされる方が対象のガイドラインになります。
乳がんの家族歴がある、高濃度乳房を持っている、または歴史的に疎外された人種および民族グループの出身であるかたは、それぞれに応じた検診を検討する必要があるでしょう。
40歳から74歳までのすべての女性が隔年でマンモグラフィーを受けるべきであるという証拠は明らかです。ただ十分に研究結果が出ているといえる分野が限られており、臨床における判断や、患者さんの病歴、価値観や好みも、意思決定においては無視できません。
高濃度の乳房があるということは、マンモグラフィーがうまく機能しない可能性があることを意味しますが、それでも検査を受けることが重要です。また、乳房の密度が高い女性は乳がんになる可能性が高く、乳房の密度が高いほど乳がんに罹患するリスクは高くなります。しかし、今回の検討からは、これらの問題の超音波、磁気共鳴画像法 (MRI) スキャン、または完全に別のものを追加することで解決するものであるかどうかは示されていません。
では何ができるでしょうか?それは医療専門家に相談するべきです。高濃度乳房を持つ女性が自分にとって何が最適かを判断できるように、追加のスクリーニング方法のメリットとデメリットについて情報を共有できます。
研究には75歳以上の女性が含まれることはほとんどないため、スクリーニングを継続すべきか中止すべきかについての証拠は明確ではありません。
何ができるでしょうか?医療専門家や 75 歳以上の女性は、スクリーニングをいつ中止するかを決定する際に、全体的な健康状態や過去のスクリーニング歴などの要素を考慮することがあります。どちらにせよ相談してみましょう。(そこに”好み”という要素が入ると思います。自分はまだまだ死ねない、元気で90まで頑張ると言われている方に、検診をやめろ、とは言わないし、言えないのです。)
USPSTF は、40 歳から 74 歳までの女性に 2 年に一度のマンモグラフィ検査を推奨しています。
USPSTFは、75歳以上の女性におけるマンモグラフィー検査の利益と害のバランスを評価するには研究が不十分であると結論付けています。
USPSTFは、マンモグラフィ検診で陰性であったとされた女性に対する乳房超音波検査またはMRIを用いた乳がんの追加スクリーニングのメリットとデメリットのバランスを評価するには研究が不十分であると結論付けています。
USPSTF はまた、BRCA関連(乳がんの発生リスクが高いとされる遺伝子変異)のある方のがん予防と乳がんのリスクを軽減するための薬物使用についても推奨しています。
この勧告を読むと、マンモグラフィ検診は たとえば遺伝的にリスクがある、高濃度乳腺である、こうした方を除けば ”隔年”で受けるべきであって、毎年受けることは推奨していない、ことになります。
ただこれはマンモグラフィ単独で検診するのであれば、毎年受けても、隔年で受けても、死亡率の減少につながらなかったことに起因します。つまり真の早期発見につながらなかったということです。実は3年に1回でも差が出ない、とする研究もあるのです。
Parvinen I, Chiu S, Pylkkänen L, et al. Effects of annual vs triennial mammography interval on breast cancer incidence and mortality in ages 40-49 in Finland. Br J Cancer. 2011;105(9):1388-1391. doi:10.1038/bjc.2011.372
マンモグラフィ単独での検診の場合、一定の確率で偽陽性、つまりがんはないのに、がんがある可能性がある、と誤って診断してしまうことは起こりえます。これは1年おきでも2年おきでもマンもグラフィ検査を受けるたびに起こります。
患者さんはそのたびに不要な検査をさらにうけることになり、何より心配になり不安になります。そして結果として異常がなければ検診そのものを信用しなくなり、検診を以降は受けなくなる恐れもあります。
これが検診による”害”です。
そしてその害は2年に1回よりも1年に1回の方が確実に起こりやすくなります。
2年に1回でも1年に1回でも、早期発見率にほぼ差が出ない。しかし害だけは増える。だから隔年で検診は受ける方がいい、USPSTFはそう推奨しました。
しかしこれは大変奇妙なことです。害が及ぶ確率が増える、これはいいでしょう。ただ一定の頻度で乳がんが発生し、ある程度一定の速度で大きくなり、進行していくのであれば、3年に1度よりも2年に1度、2年に1度よりも1年に1度の方が早期発見されるかたはそれだけ多くならないといけない。なぜそうならないのか?
これを説明する一つの仮説があります。
一般にがんは大きくなるほど、時間が経過しており、転移をきたしている可能性が高くなります。
がんが助けられないのは、転移するから、です。がんが乳腺にとどまっていれば手術や放射線で見つかったがんを切除してしまえば治癒します。助けられないのは、見つかった時にすでに全身に見えない微小ながんが転移している場合です。つまり転移する前に見つけることこそ重要で治癒につなげることができる、それが早期発見です。現状の検査では微小転移があるかどうかはわかりませんから、できるだけ小さく見つけて、転移を起こしている確率を下げることを目指すわけです。
そこでその仮説とは
「乳がんは、大きさに関係なく、見つかった時には、つまり見つかる大きさにまでなっていれば、転移するがんはすでに転移しており、逆に転移しないがんは大きくなったからと言って転移しない」というものです。一時期 近藤誠先生がこの立場をとって話題になっていました。
見つかった段階で大きさは関係なく、その乳がんのタイプによってするものはすでに転移しており、しないものは大きくても転移していない。そうであれば結局真の早期発見は検診を1年おきでも2年おきでも関係なくなります。つまりうまく説明できるのです。
一部では正しいかもしれません。ただそれだと乳がん検診を受けることで死亡抑制効果があること自体が説明できなくなってしまいます。
先にも触れましたが、USPSTFでも「乳がん検診を受けることによって、乳がんをより治療が容易な段階で発見することが可能となり、クオリティオブライフ(生活の質)を落とすことなく、乳がんで死亡することから救うことができるようになります。」と宣言しているのですから。
検診で乳がん死を抑制できることは確実です。でもその間隔はあまり影響しない、それはなぜなのでしょう。まだなぞは残ります。
これは私の考えですが、
「乳がんは、大きさに関係なく、見つかった時には、つまり見つかる大きさにまでなっていれば、転移するがんはすでに転移しており、逆に転移しないがんは大きくなったからと言って転移しない」
のではなく、
「乳がんは、大きさに関係なく、マンモグラフィで発見された時に、その方の乳腺の濃度が高ければ進行がんであることが多く、濃度が低い方では見つかった際に早期であることが多い」からではないか、と思っています。
つまり見つかった段階で早期かどうかはその方の乳がんのタイプで決まっているのではなく、その方の乳腺濃度によるから、なのではないか、と思うのです。
これに関してはこのブログでも何度も触れてきました。特に1はぜひ見ておいてください。
1 高濃度乳腺とは ーAre You Dense?ー
2 高濃度乳腺の乳がんリスクについて
3 ”高濃度乳腺は乳がんリスクが高い”ことを知っていますか?
”見つかった段階で早期かどうかはその方の乳がんのタイプで決まっているのではなく、その方の乳腺濃度によるから”とはいっても、もちろんそれは必ず言い切れるものではありません。濃度は1か100かではなく、その方によって程度に差があるからです。ですので一部の方にはそう言えるし、一部ではそういえない。だからある程度まではマンモグラフィ検診を施行しておけばきちんと差が出ます。ただそれでは100には決してならない。それは乳腺濃度の高い方ではマンモグラフィ検診を定期的に受診していても、発見された際に早期とは限らない、からです。つまり”見つかった段階で早期かどうかはその方の乳がんのタイプで決まっているのではなく、その方の乳腺濃度によるから”です。
この勧告でも 高濃度乳腺を持つ方 は別に議論されていることに注意してください。
つまり2年おきのマンモグラフィ検診がベストと言えるのは、乳腺濃度が低く、家族歴に乳がんの方がおられない、リスクの低い方に限定した話なのです。濃度の高い、リスクの高い方はどのように検診を受けていけばいいか、はまだ”研究が不十分”なのです。米国ではMRIの役割に注目が集まっていますが、これをどの間隔でどのように運用するかはまだわかっていません。また一度でもMRI検査を受けられた方はご存じですが、定期健診で受けるには受診者、医療側双方の負担が重い検査です。
この勧告がでたことで、”マンモグラフィ検診は隔年がいい” ”毎年はよくないらしいよ” と言われる方も友人におられるかもしれません。ただ我が国ではすでに隔年で地域ぐるみ検診が行われてはいますが、お住まいの地域によっては60歳までで74歳まで網羅していない自治体も多く存在します。このようにガイドラインの一部は採用するけれど、一部は無視するのではあれば、それはガイドラインに準拠するとは言えません。ガイドラインやルールは、そのすべてを守ってこそ役に立つものなのです。都合のいいところだけを抜き出して他人に強要することが間違いなのは感覚的にもわかります。
”隔年がいい”のその一部だけを抜き出して全員に強調することは間違いなのです。
それを付け加えておきます。
2024.04.18
英国ランセット乳がん委員会の最近の報告書によると、研究者らは、乳がんにおける研究、治療、生存率が最近改善されているにもかかわらず、多くの患者を体系的に取り残している可能性があるとし、そこには根強い不平等があることを明らかにしました。
乳がんは現在、世界で最も一般的ながんの種類と考えられています。 2020年末までに、過去5年間で780万人の女性が乳がんと診断されました。これは乳がん分野における研究とがん管理の進歩を表しており、ほとんどの高所得層の国々では乳がんによる死亡率は40%以上減少しています。
しかしその一方で2020年には68万5,000人の女性がこの病気で死亡しました。乳がんによる身体的症状、精神的絶望、経済的負担に関連する不平等は、しばしばこうした研究論文では話題にされず、十分に対処されていません。
ランセット乳がん委員会の最近の報告書では、研究者らは乳がんにおける不平等に取り組むための新たな戦略を特定しようと努めています。彼らは、世界の乳がんの新規症例数は2020年の230万人から2040年までに300万人以上に増加し、乳がん死亡率は2040年までに年間100万人に増加し、この影響は低所得国と中所得国に対して、より不均衡に起こりえると推定しました。(なぜ乳がんが増えているのか、については以前のこと記事を参照してください。)
研究者らは、乳がんの蔓延にもかかわらず、乳がんに関する知識には大きなギャップ、つまり偏りがあり、効果的な対策を妨げ続け、転移性乳がんの対策の遅れにつながっていると指摘しました。
たとえば、早期乳がん患者の 20 ~ 30% が再発を経験する可能性がありますが、英国国内がん登録の大部分には通常、再発が記録されていません。したがって、転移性乳がんを抱えて生きている患者の数は現在不明であり、治療とケアの提供が妨げられています。さらに、転移性疾患を抱えて生きる多くの患者は、しばしば見捨てられ、孤立したと感じているという研究結果があります。
たしかに過去 10 年間で、転移性乳がんの転帰は大幅に改善されました。
HER2陽性乳がん患者さん、エストロゲン受容体陽性/HER2陰性乳がん患者さんの転移性乳がん患者(転移性乳がん患者の約85%を含む)の全生存期間中央値は、推奨される治療法が利用可能になった時点で5年に達しています。一部の患者さんでは現在、転移性疾患で 10 年以上の生存さえ経験する可能性があります。
382人の医療専門家(その70%は主に乳がんを臨床専門とする腫瘍専門医)を対象とした委員会の最近の調査では、55%が転移性乳がんの特定のサブタイプが治癒可能になる可能性がある!ことに同意し、75%が転移性乳がんが治療可能になる可能性があることに同意しました。そうなればがんは慢性疾患、治らないかもしれないが、それで死ぬことはない疾患、になるでしょう。
「(転移性乳がんは)依然として国民、政策立案者、さらには医療専門家にさえほとんど理解されていません」と、協力者であり患者擁護者のレスリー・スティーブン氏は説明します。
「何人かの患者は、自分が失望したと感じていると私に言いました。この無視され取り残されているという感覚は、彼らが助けを求めたり、自分たちを助ける可能性のある臨床研究に参加したりするような積極的な行動から彼らを遠ざけてしまう可能性があります。転移性乳がんの診断によって、患者さんの社会への貢献が止まるわけではありません、しかしそれでも転移性疾患の患者さんが、自分が必要とされている、大切にされていると感じるためには、より多くの支援と情報が必要です」と彼女は続けました。
研究者らは、世界中のがん登録の少なくとも 70% にがんの病期と再発を記録する必要があると提案しました。まずはデータがなければ実態が把握できず、社会のモーションも始まりません。もしデータが明らかになれば、転移性乳がんの治療、転帰、患者の精神的健康を大幅に改善する可能性があります。
転移性乳がんを抱えて生きる患者の社会援助を促進する取り組みもまた重要です。たとえば、より柔軟な勤務形態を可能にする労働基準法の改正などです。こうしたことで、まずは否定的な社会的態度から認識を変化させ、最適なサポートを促進し、ほとんどの転移性疾患を治療し、この患者集団の苦痛を軽減することが可能になる可能性があります。
同時に、乳がん関連コストの規模は適切に測定されておらず、政策立案者や社会によって無視されたままです。 「社会と政策立案者は現在、氷山の一角しか見ていない」と委員会の執筆者は述べました。乳がんにかかわるコストには、定期的な検診の受診、そして診断から治療に至るもの、再発があればそこから延々と続く通院や、治療のコスト、これらの過小認識されている乳がんのコストは、経済的、身体的、精神的、感情的、社会的なものの多岐にわたっており、患者とその家族、そしてより広い社会に影響を与える可能性があります。しかし現在の世界的な健康指標ではそうした目に見えにくいコストや負担は完全には捉えられていません。まずはそれを目に見える形でデータ化することです。
これに応えて、研究者らは、乳がん患者が経験する経済的負担と社会的な支援の必要性の概要を提供するために、英国 CASCARA を拠点とするパイロット研究を設立しました。同委員会が調査した606人の乳がん患者とその介護者のほぼ全員が、失業や性的機能不全など、乳がんに関連した身体的または健康上の問題を抱えていると述べました。
さらに、早期乳がんの参加者の20%と27%、転移性乳がんの参加者の25%と35%が、それぞれ治療のための交通費の負担と経済的問題を報告しました。このパイロット研究の結果は、診療時点では無料の医療保険制度がある国であっても、乳がん患者には交通費や、家族が仕事を休んで介護を行うことに伴う負担など、隠れたコストがかかる可能性があることを示唆しています。
研究者らは、これまでの研究に基づいて、乳がん患者が深刻な健康関連の苦痛を経験しており、これは緩和ケアの必要性の指標であることも示しました。 2020年に世界で乳がんによる死亡者数が68万5,000人と報告されていることに基づくと、乳がんにより死亡した患者のうち、年間のべ1億2,000万日が深刻な健康関連の苦しみを抱えて過ごしていると推定されます。再発から亡くなるまでの平均期間を考えれば、この苦しみとともに生きる患者の期間は合計のべ5億2,000万日に上ると推定されました。こうした期間の間、患者さんたちは痛み、息切れ、疲労、その他の多くの場合解決可能な苦痛で苦しんでおられることが明らかになりました。
「乳がんの影響は広範囲に及んでおり、私たちの報告書に含まれる研究は、すべての疾患段階において、関連する苦しみと、自己否定的な経験の巨大さを示唆しています。医療制度が十分に発達した国であっても、乳がん患者のサポートやケアは十分とは言えません。手頃な価格の医療施設が不足している国では、患者はこれらの費用をより一般的かつ深刻に経験し、そして予想できることですが壊滅的な出費と貧困につながっていることでしょう。
乳がんに罹患しているすべての個々の患者さんのの多様なニーズを明らかにし、よりよく理解し、それに対処し、予防可能な苦しみによる世界的な負担を大幅に軽減するには、世界規模のデータが不可欠です」と共同研究著者である腫瘍学研究者のカルロス・バリオス医学博士(ブラジル サン・ルーカス センター病院)は強調しました。
研究者らは、乳房疾患に関連する多くのコストを特定し、把握するための新しいツールと指標の開発を提唱しました。この測定から得られるデータは、政策立案者が乳がんの予防、早期発見、費用対効果の高い治療、最適な管理、経済的保護、および苦しみを和らげるために設計されたその他の社会的な介入に投資するための指針となるはずです。(日本でもそうなることを願います)
研究者らはまた、新たに乳がんと診断された女性は、すぐに無力感を感じると報告することが多いと指摘しました。したがって、患者と医療専門家のコミュニケーションを強化することは、生活の質、意思決定、身体イメージ、治療遵守を改善するために重要である可能性があり、生存にプラスの影響を与える可能性があります。(それこそは私のようなものの役割なのでしょう)
「女性の基本的人権は、歴史的にあらゆる場面で男性に比べて尊重されておらず、患者の主体性や自律性に影響を与えてきました。すべての医療専門家は、何らかのコミュニケーション スキルのトレーニングを受ける必要があります。患者と医療側の専門家との間のコミュニケーションの質を向上させることは、一見簡単そうに見えますが、乳がん管理の特定の状況をはるかに超えて広がる重大なプラスの影響をもたらす可能性があります。患者は、乳がんに対する医療ケアの決定に対して、その関与のレベルを自ら選択し、自分の意見を表明するよう奨励されるべきです」と共同研究著者であるエモリー大学医学部教授のレシュマ・ジャグシ医学博士は強調しました。
研究者らは、すべての国の医療従事者の100%がコミュニケーションスキルのトレーニングを受け、乳がんの臨床研究のすべての段階(概念から臨床実践への移行に至るまで)に、患者もまた関与するよう求めました。つまり必要なことを必要だ、と医療従事者に伝え、医療従事者もそれをきちんと聞き、汲み取る技術を持たないといけないということです。
まとめ
ソクラテスの言葉で「無知の知」(自分が知らないということをまず知らなければならない)という言葉があります。まず知らないことを知らなければ学ぶこともしませんからね。
乳がんにおいては、検診、診断治療、そして再発からその後まで、様々な時点で社会的な弱者ほど、医療の進化の恩恵を受けられず、依然として苦しみの中で放置されています。乳がんという身近な脅威を知らない、知っていてもどうしたらいいか知らない、それでは対策はとれません。
特に転移性乳がんにおいては、目に見えない形で多くのコストがかかり、社会的に弱い立場の方は追い詰められ、より悲劇的な状況に陥りやすくなっています。つまり医療側も、こうした人が追い詰められていることを「知らない」のです。
まず社会はそれをデータとして目に見える形で把握する必要があります。
そしてそれを解決するための戦略を、患者、医療従事者ともに確立していく必要があります。
ご予約専用ダイヤル
079-283-6103