2024.04.18
英国ランセット乳がん委員会の最近の報告書によると、研究者らは、乳がんにおける研究、治療、生存率が最近改善されているにもかかわらず、多くの患者を体系的に取り残している可能性があるとし、そこには根強い不平等があることを明らかにしました。
乳がんは現在、世界で最も一般的ながんの種類と考えられています。 2020年末までに、過去5年間で780万人の女性が乳がんと診断されました。これは乳がん分野における研究とがん管理の進歩を表しており、ほとんどの高所得層の国々では乳がんによる死亡率は40%以上減少しています。
しかしその一方で2020年には68万5,000人の女性がこの病気で死亡しました。乳がんによる身体的症状、精神的絶望、経済的負担に関連する不平等は、しばしばこうした研究論文では話題にされず、十分に対処されていません。
ランセット乳がん委員会の最近の報告書では、研究者らは乳がんにおける不平等に取り組むための新たな戦略を特定しようと努めています。彼らは、世界の乳がんの新規症例数は2020年の230万人から2040年までに300万人以上に増加し、乳がん死亡率は2040年までに年間100万人に増加し、この影響は低所得国と中所得国に対して、より不均衡に起こりえると推定しました。(なぜ乳がんが増えているのか、については以前のこと記事を参照してください。)
研究者らは、乳がんの蔓延にもかかわらず、乳がんに関する知識には大きなギャップ、つまり偏りがあり、効果的な対策を妨げ続け、転移性乳がんの対策の遅れにつながっていると指摘しました。
たとえば、早期乳がん患者の 20 ~ 30% が再発を経験する可能性がありますが、英国国内がん登録の大部分には通常、再発が記録されていません。したがって、転移性乳がんを抱えて生きている患者の数は現在不明であり、治療とケアの提供が妨げられています。さらに、転移性疾患を抱えて生きる多くの患者は、しばしば見捨てられ、孤立したと感じているという研究結果があります。
たしかに過去 10 年間で、転移性乳がんの転帰は大幅に改善されました。
HER2陽性乳がん患者さん、エストロゲン受容体陽性/HER2陰性乳がん患者さんの転移性乳がん患者(転移性乳がん患者の約85%を含む)の全生存期間中央値は、推奨される治療法が利用可能になった時点で5年に達しています。一部の患者さんでは現在、転移性疾患で 10 年以上の生存さえ経験する可能性があります。
382人の医療専門家(その70%は主に乳がんを臨床専門とする腫瘍専門医)を対象とした委員会の最近の調査では、55%が転移性乳がんの特定のサブタイプが治癒可能になる可能性がある!ことに同意し、75%が転移性乳がんが治療可能になる可能性があることに同意しました。そうなればがんは慢性疾患、治らないかもしれないが、それで死ぬことはない疾患、になるでしょう。
「(転移性乳がんは)依然として国民、政策立案者、さらには医療専門家にさえほとんど理解されていません」と、協力者であり患者擁護者のレスリー・スティーブン氏は説明します。
「何人かの患者は、自分が失望したと感じていると私に言いました。この無視され取り残されているという感覚は、彼らが助けを求めたり、自分たちを助ける可能性のある臨床研究に参加したりするような積極的な行動から彼らを遠ざけてしまう可能性があります。転移性乳がんの診断によって、患者さんの社会への貢献が止まるわけではありません、しかしそれでも転移性疾患の患者さんが、自分が必要とされている、大切にされていると感じるためには、より多くの支援と情報が必要です」と彼女は続けました。
研究者らは、世界中のがん登録の少なくとも 70% にがんの病期と再発を記録する必要があると提案しました。まずはデータがなければ実態が把握できず、社会のモーションも始まりません。もしデータが明らかになれば、転移性乳がんの治療、転帰、患者の精神的健康を大幅に改善する可能性があります。
転移性乳がんを抱えて生きる患者の社会援助を促進する取り組みもまた重要です。たとえば、より柔軟な勤務形態を可能にする労働基準法の改正などです。こうしたことで、まずは否定的な社会的態度から認識を変化させ、最適なサポートを促進し、ほとんどの転移性疾患を治療し、この患者集団の苦痛を軽減することが可能になる可能性があります。
同時に、乳がん関連コストの規模は適切に測定されておらず、政策立案者や社会によって無視されたままです。 「社会と政策立案者は現在、氷山の一角しか見ていない」と委員会の執筆者は述べました。乳がんにかかわるコストには、定期的な検診の受診、そして診断から治療に至るもの、再発があればそこから延々と続く通院や、治療のコスト、これらの過小認識されている乳がんのコストは、経済的、身体的、精神的、感情的、社会的なものの多岐にわたっており、患者とその家族、そしてより広い社会に影響を与える可能性があります。しかし現在の世界的な健康指標ではそうした目に見えにくいコストや負担は完全には捉えられていません。まずはそれを目に見える形でデータ化することです。
これに応えて、研究者らは、乳がん患者が経験する経済的負担と社会的な支援の必要性の概要を提供するために、英国 CASCARA を拠点とするパイロット研究を設立しました。同委員会が調査した606人の乳がん患者とその介護者のほぼ全員が、失業や性的機能不全など、乳がんに関連した身体的または健康上の問題を抱えていると述べました。
さらに、早期乳がんの参加者の20%と27%、転移性乳がんの参加者の25%と35%が、それぞれ治療のための交通費の負担と経済的問題を報告しました。このパイロット研究の結果は、診療時点では無料の医療保険制度がある国であっても、乳がん患者には交通費や、家族が仕事を休んで介護を行うことに伴う負担など、隠れたコストがかかる可能性があることを示唆しています。
研究者らは、これまでの研究に基づいて、乳がん患者が深刻な健康関連の苦痛を経験しており、これは緩和ケアの必要性の指標であることも示しました。 2020年に世界で乳がんによる死亡者数が68万5,000人と報告されていることに基づくと、乳がんにより死亡した患者のうち、年間のべ1億2,000万日が深刻な健康関連の苦しみを抱えて過ごしていると推定されます。再発から亡くなるまでの平均期間を考えれば、この苦しみとともに生きる患者の期間は合計のべ5億2,000万日に上ると推定されました。こうした期間の間、患者さんたちは痛み、息切れ、疲労、その他の多くの場合解決可能な苦痛で苦しんでおられることが明らかになりました。
「乳がんの影響は広範囲に及んでおり、私たちの報告書に含まれる研究は、すべての疾患段階において、関連する苦しみと、自己否定的な経験の巨大さを示唆しています。医療制度が十分に発達した国であっても、乳がん患者のサポートやケアは十分とは言えません。手頃な価格の医療施設が不足している国では、患者はこれらの費用をより一般的かつ深刻に経験し、そして予想できることですが壊滅的な出費と貧困につながっていることでしょう。
乳がんに罹患しているすべての個々の患者さんのの多様なニーズを明らかにし、よりよく理解し、それに対処し、予防可能な苦しみによる世界的な負担を大幅に軽減するには、世界規模のデータが不可欠です」と共同研究著者である腫瘍学研究者のカルロス・バリオス医学博士(ブラジル サン・ルーカス センター病院)は強調しました。
研究者らは、乳房疾患に関連する多くのコストを特定し、把握するための新しいツールと指標の開発を提唱しました。この測定から得られるデータは、政策立案者が乳がんの予防、早期発見、費用対効果の高い治療、最適な管理、経済的保護、および苦しみを和らげるために設計されたその他の社会的な介入に投資するための指針となるはずです。(日本でもそうなることを願います)
研究者らはまた、新たに乳がんと診断された女性は、すぐに無力感を感じると報告することが多いと指摘しました。したがって、患者と医療専門家のコミュニケーションを強化することは、生活の質、意思決定、身体イメージ、治療遵守を改善するために重要である可能性があり、生存にプラスの影響を与える可能性があります。(それこそは私のようなものの役割なのでしょう)
「女性の基本的人権は、歴史的にあらゆる場面で男性に比べて尊重されておらず、患者の主体性や自律性に影響を与えてきました。すべての医療専門家は、何らかのコミュニケーション スキルのトレーニングを受ける必要があります。患者と医療側の専門家との間のコミュニケーションの質を向上させることは、一見簡単そうに見えますが、乳がん管理の特定の状況をはるかに超えて広がる重大なプラスの影響をもたらす可能性があります。患者は、乳がんに対する医療ケアの決定に対して、その関与のレベルを自ら選択し、自分の意見を表明するよう奨励されるべきです」と共同研究著者であるエモリー大学医学部教授のレシュマ・ジャグシ医学博士は強調しました。
研究者らは、すべての国の医療従事者の100%がコミュニケーションスキルのトレーニングを受け、乳がんの臨床研究のすべての段階(概念から臨床実践への移行に至るまで)に、患者もまた関与するよう求めました。つまり必要なことを必要だ、と医療従事者に伝え、医療従事者もそれをきちんと聞き、汲み取る技術を持たないといけないということです。
まとめ
ソクラテスの言葉で「無知の知」(自分が知らないということをまず知らなければならない)という言葉があります。まず知らないことを知らなければ学ぶこともしませんからね。
乳がんにおいては、検診、診断治療、そして再発からその後まで、様々な時点で社会的な弱者ほど、医療の進化の恩恵を受けられず、依然として苦しみの中で放置されています。乳がんという身近な脅威を知らない、知っていてもどうしたらいいか知らない、それでは対策はとれません。
特に転移性乳がんにおいては、目に見えない形で多くのコストがかかり、社会的に弱い立場の方は追い詰められ、より悲劇的な状況に陥りやすくなっています。つまり医療側も、こうした人が追い詰められていることを「知らない」のです。
まず社会はそれをデータとして目に見える形で把握する必要があります。
そしてそれを解決するための戦略を、患者、医療従事者ともに確立していく必要があります。
2024.04.15
基本的に乳管内乳頭腫は、細胞診で診断されることはほぼあり得ません。最低でも針生検、あるいはUS-VAB(吸引式組織診)など組織の“一部”を採取することで初めて診断がなされます。
もちろん乳管内乳頭腫は”良性“であるので、原則として切除は不要です。
問題は一部を採取した検査においては良性と診断されたのに、後に全体を切除して生検すれば一部にがんがあった、悪性であった、いわゆるアップグレードと表現されるものです。それがしょっちゅう起こるのであれば、いくら検査で乳管内乳頭腫、つまり良性と診断されても安心できないということになります。
結果として偽陰性であったということになりますが、それが起こる確率はどれくらいのものなのでしょうか、そして偽陰性を防ぐ手立てはあるのでしょうか。
まず知っておいていただきたいことに、病理医は針生検の診断時に、乳管内乳頭腫に“異型がある”、“異型がない”を区別しているときがあります。当然針生検標本で異型があるとする場合は、乳管内乳頭腫と診断していても全体を切除してみればがんである可能性が高い、つまりアップグレードする確率が高いと判断していることの裏返しになり、臨床の現場ではより警戒することとなります。それもあわせて検討してみましょう。

論文1:針生検で乳管内乳頭腫と診断された55症例において、69.1% (n = 38) が異型性のない乳管内乳頭腫を有し、30.9% (n = 17) が異型性のある 乳管内乳頭腫を有していました。
切除生検で、良性と診断されたすべての乳管内乳頭腫のうち、切除生検でグレードアップとなったのは 55 人中 4 人 (7.3%)でした。
これらすべてのグレードアップした症例は最初の針生検で異型を証明できませんでした(つまり生検時に異型があるかどうかは関係しない)。[1]
論文2:166 人の乳管内乳頭腫と診断された女性が 手術による摘出生検を受けました。アップグレード率は 2.3% (171 件中 4 件) でした。[2]
論文3:異型性がないとされた 126 人の乳管内乳頭腫の症例が特定されました。アップグレード率は1.58%(2/126)でした。[3]
論文4:44の論文から7016例の乳管内乳頭腫の症例を集めて検討しました。 ”異型性のある“乳管内乳頭腫のアップグレード率は36%!(95% CI 32.7–39.2%)、 ”異型性のない“乳管内乳頭腫のアップグレードの確率は5%(95% CI 4.4–5.5%)でした。[4]
論文5:13 件の研究論文を集めて総合して検討をし直している(メタ解析)。癌腫の過小評価率(いわゆるアップグレード率)の統合推定値は 1.4% (95% CI: 0.8%-2.0%) でした。[5]
こうした研究を行う際に問題になるのは、その研究対象になった患者さんの主治医は、乳管内乳頭腫と診断された病変のすべてを手術に回していない、という点になります。
もし針生検で乳管内乳頭腫と診断された、そのすべてを手術で生検すれば当然アップグレード率は下がります。そのうち多くは本当に乳管内乳頭腫でしょうから。そこで主治医が何らかの基準をもって“選択”して手術を施行すればアップグレード率は上がります。その一つは病理医の指摘する“異型を伴っている”乳管内乳頭腫です、とする診断でしょう。
こうして論文間でアップグレード率に大きな差が生じています。
乳管内乳頭腫は“異型度を伴う”ものと“伴わない”ものを区別する病理診断が下りることがあるのも事実です。諸説ありますが、異型度を伴うとされればがんの合併率は高いと考えるのが普通です。しかし論文4だけを特殊として検討する限り、他の論文からはそれだけを根拠に生検するべきとは言えないでしょう。
針生検で乳管内乳頭腫と診断された際には、生検ではその全体を診ているわけではない、という問題点があります。乳管内乳頭腫と診断されたものをすべて切除によって全体を見直してみたら、やはり悪性だったと診断されるいわゆるアップグレードの確率は、1~5%前後と考えるべきでしょう。
乳管内乳頭腫、すなわち良性と診断されても、病理は異型の有無を検討します。それはアップグレード、つまり偽陰性を防ぎたいからです。またたとえば大きさはどうでしょうか? たとえば1cmを超えていれば、アップグレードが起こる可能性は高まるのではないか?そういう考え方もあります。論文からこの問題を考えてみましょう。自分が調べた範囲内ではメタアナリシスを施行した論文は3つ見つかりました。[4-6]
以下はX Zhang(2021年 7016例の乳管内乳頭腫)のレポートを参照しました
1 50歳以上か: 高い方が2.3倍アップグレードしやすい。
2 乳頭から血性分泌がある: ある方が3.1倍アップグレードしやすい(血性でなければ関係ない)
3 乳管内乳頭腫を触知できる:ある方が3.3倍アップグレードしやすい
4 乳管内乳頭腫とされた腫瘤が1cmを超えている:超えていれば5.4倍アップグレードしやすい
5 マンモグラフィ検査で乳管内乳頭腫が見える:見えれば2.5倍、さらに石灰化を伴えば5.7倍アップグレードしやすい
6 MRIで所見がある:カテゴリー3から4Aを基準とすれば、C4Bでは5.9倍、C4Cでは16.5倍、C5では27.4倍とアップグレードしやすい。
7 乳腺の端にある方が乳頭近くにあるよりも3.1倍アップグレードしやすい
以下はKeating(2024年 1587例の乳管内乳頭腫)のレポートから参考とした
1 50歳以上か: 有意差はない。
2 乳管内乳頭腫を触知できる:有意差はない。
3 乳頭から分泌がある:有意差はない
4 MMGで所見がある:有意差はない
5 乳頭からの距離:有意差はない
以下はWen(2013年 2236例の乳管内乳頭腫)のレポートから参考とした[7]
1 50歳以上か: 50歳以下を基準とした際に、以上であれば有意差をもってアップグレード率は高い
2 乳管内乳頭腫を触知できる:ある方が3.7倍アップグレードしやすい
3 マンモグラフィ検査で乳管内乳頭腫が見える:見えれば5.8倍アップグレードしやすい
4 乳頭からの距離によって有意差はない
5 大きさによって有意差はない
6 病理的に異型を伴っていれば、5.3倍アップグレードしやすい
論文間で差があるので確定的ではありませんが、より多くの患者さんで検討した大規模な検討であればより信頼性が高いといえます。それからいえることとしては
1 触診、マンモグラフィ、MRIなどで、がんを疑う所見があれば乳管内乳頭腫と診断されても手術による摘出生検を検討すべき(かもしれません)
2 病理医が、乳管内乳頭腫ですが異型があります、と診断すれば、手術による摘出生検を検討すべき(かもしれません)
3 どちらにしても、手術しないのであれば厳重な経過観察は必要です。
1.Gillani M, Idress R, Afzal S, Khan M, Shahzad H, Sattar AK. Management of Breast Intraductal Papilloma Diagnosed on Core Needle Biopsy: Excision or Follow-up? Cureus. 2024.
2.Pareja F, Corben AD, Brennan SB, Murray MP, Bowser ZL, Jakate K, et al. Breast intraductal papillomas without atypia in radiologic‐pathologic concordant core‐needle biopsies: Rate of upgrade to carcinoma at excision. Cancer. 2016; 122: 2819-27.
3.Genco IS, Tugertimur B, Manolas PA, Hasanovic A, Hajiyeva S. Upgrade rate of intraductal papilloma without atypia on breast core needle biopsy: A clinical, radiological and pathological correlation study. Am J Surg. 2020; 220: 677-81.
4.Zhang X, Liu W, Hai T, Li F. Upgrade Rate and Predictive Factors for Breast Benign Intraductal Papilloma Diagnosed at Biopsy: A Meta-Analysis. Ann Surg Oncol. 2021; 28: 8643-50.
5.Keating N, Cevik J, Hopkins D, Lippey J. Malignant upgrade rate and associated clinicopathologic predictors for concordant intraductal papilloma without atypia: A systematic review and meta-analysis. J Surg Oncol. 2024.
6.Wen X, Cheng W. Nonmalignant breast papillary lesions at core-needle biopsy: a meta-analysis of underestimation and influencing factors. Ann Surg Oncol. 2013; 20: 94-101.
7.Limberg J, Kucher W, Fasano G, Hoda S, Michaels A, Marti JL. Intraductal Papilloma of the Breast: Prevalence of Malignancy and Natural History Under Active Surveillance. Ann Surg Oncol. 2021; 28: 6032-40.
2024.04.15
外来をしていると、だれがどう見てもこれは進んでいるな、と思う乳がん患者さんに出会うことがあります。ときに気づかれていてもこれは乳がんではない、と考えておられる方もいますが、乳がんは大きくなってくるとそれと自覚される症状が出ますので、残酷ですが必ず目を背け続けることはできないタイミングがやってきます。誰にも気づかれないまま病状が進行し、ある日ある時そっとこの世を去っていく、乳がんは決してそうはいかない病気なのです。
どうしてこんなになるまで放置していたんですか?検診を受けておられなかったのですか?
子供が受験で時間がなかったんです、母親の介護で時間が取れなくて、親が認知症で遠方なので通っていたら予約のタイミングが合わなくて…
そうした患者さんがよくいわれるその理由です。しかしそんな子供さんや、親を抱えているからこそ、ご本人が元気でなければ支えることなどできません。むしろそうした方が倒れてしまえば、すべては最悪の方向に向かっていきます。つまり矛盾した行動パターンなのです。
おそらくそんなことは百も承知なのでしょう。それでも受診できないときは受診できない、そうなのでしょう。
米国疾病予防管理センターの最近の研究で、女性が食事の不安や医療費の余裕がない など、健康に関連した社会保障を必要とするような状況を抱えているほど、乳がんに対して推奨される検査であるマンモグラフィーを受ける可能性が低くなっていることが判明しました。本研究では、その中で検診にかかるコストが最大の障壁であることが判明しました。
https://edition.cnn.com/2024/04/09/health/mammogram-barriers-cdc-study-wellness/index.html
この研究では、米国の成人を対象とした年次健康調査である2022年行動危険因子監視システムのデータを分析しました。研究者らは、3つ以上の健康関連の社会保障を必要とするような状況を抱えている50歳から74歳の女性では、こうした健康関連の社会保障の必要性がまったくない女性と比較して、推奨されるマンモグラフィー検診の利用がほぼ 20%低いことを発見しました。
健康関連の社会保障の必要性(これを社会的ニーズと呼びます)とは、人の健康に悪影響を与える社会的状況を意味します。
報告書によると、社会的孤立感、生活への不満、パートなどの雇用時間の喪失または減少、信頼できる交通手段の欠如、医療アクセスの障壁となる費用などの社会的ニーズは、過去 2 年間にマンモグラフィーを受けなかったことと関連していました。そして特に医療機関を受診することでかかる費用が、マンモグラフィー検査を受ける最大の障壁であることが判明しました。
「女性が必要なマンモグラフィー検診を受けられるよう支援するために、私たちはこうした健康関連の社会的ニーズに対応しなければなりません」と米国国際安全衛生センターの首席医療責任者であるデブラ・ホーリー博士はニュースリリースで述べました。
「これらの課題を特定し、これらのニーズに対処するために医療、社会サービス、地域団体、公衆衛生の間で取り組みを調整することで、乳がん検診を増やす取り組みが改善され、最終的にはこれらの悲劇的な損失から家族を救うことができるでしょう。」
米国国際安全衛生センターによると、米国では乳がんにより毎年 40,000 人以上の女性が死亡しています。また、米国では乳がんの発生率は減少傾向にありますが(日本ではまだ増加傾向です)、その減少がすべての国民に均等に分配されているわけではありません。研究によると、黒人女性や社会経済的地位が低い女性は乳がんで死亡する可能性が高いことがわかっています。
マンモグラフィ検査とは、医師が乳がんの初期兆候を見つけるために使用する乳房の X 線写真です。国立乳がん財団によると、乳がんは早期に発見されるほど治療が容易になります。ウーリー氏は記者会見で、定期的なマンモグラム検診により乳がんによる死亡が22%減少することが示されていると述べました。(これに関しては、この記事でも触れていますので参考にしてください。)
米国予防サービス特別委員会は 現在、50歳から74歳までの女性は2年ごとにスクリーニングマンモグラフィーを受け、40歳から49歳までの女性はマンモグラフィーを受け始める時期と頻度について医療従事者と相談することを推奨しています。
米国疾病予防管理センターの本研究では、健康関連の社会的ニーズに問題のない50歳から74歳の女性の83%が過去2年以内にマンモグラフィーを受けているのに対し、健康関連の社会的ニーズが3つ以上ある同年齢層の女性のうちマンモグラフィーを受けられたのはわずか66%であることが判明しました。同研究によると、州レベルでも差があり、ロードアイランド州では50~74歳の女性の86%が推奨マンモグラフィーを受けているのに対し、ワイオミング州ではわずか64%の女性にとどまりました。(これは日本のような小さな国でも見られます。県によってクーポン検診の受診率にはかなりの差があります。)
黒人女性の方がマンモグラフィー利用率が高いが、その背後にある理由はデータからは識別できないと、ジャクリーン・ミラー博士は記者会見で述べました。
この研究によると、マンモグラフィー検診の利用率が最も低いのは、低所得で健康保険を持たず、定期的に医療を受けられない女性たちだといいます。しかし、これらの新たな発見は、コスト以外の他の健康関連の社会的ニーズの問題も役割を果たしていることを示しているとミラー氏は述べた。
「要するに、社会的ニーズが満たされると、女性は命を救うマンモグラフィーを受けられる可能性が高くなるということです」とミラー氏は記者会見で述べました。(米国には日本のような皆保険制度はありませんし、日本でも検診は原則自費ですが)、米国の保険制度であるメディケアメディケア・メディケイド・サービスセンターは 今年から、患者の健康関連の社会的ニーズを特定し、文書化するための評価の実施に対して、医療提供者にコストの支払いを認める新しい請求コードを導入しました。
ミラー氏は、こうしたリスクの評価は患者受け入れの日常的な一部となるべきだと述べました。
「医療提供者は女性が健康に関連した社会的ニーズに問題があるかどうかを評価し、女性が必要なサービスを受けられるよう支援できるようになりました。すべての女性は障害なく乳がんの検査を受けられるべきです」と米国国際安全衛生センターがん予防管理部門の責任者であるリサ・C・リチャードソン博士はニュースリリースで述べました。
ニュースリリースによると、患者はほとんどの民間医療保険プランやメディケアを通じてマンモグラフィーを無料で利用できるといいます。保険に加入していない低所得者は、米国国際安全衛生センターの国家乳がんおよび子宮頸がん早期発見プログラムを通じて、無料または低料金の乳がんおよび子宮頸がんのスクリーニング サービスを利用できます。
「生活に関わるすべての女性がマンモグラフィーを受けることを、家庭、職場、地域社会は奨励し、支援してください」とアウリー氏は述べました。 「これを先延ばしにしないでください。役立つサービスがあります。」
日本では、クーポンによるマンモグラフィ検診の補助が行われていますが、自治体によって補助を受けられる年齢や、そのタイミングに差があります。
またすでに米国では採用されている60歳以上の女性に対する検診への対応は遅れています。
検診に対して補助を出してくださっている会社もあるようですが、まだまだ一般的ではありません。
検診を受けるのにはコストが最大の障壁になっていること、そして社会的ニーズに問題を抱えている方ほど検診が受けられず、つらい人生をより深刻にする悲劇の原因になっていることを考えれば、家庭、職場、地域社会、そのすべてでマンモグラフィ検診を奨励し、支援してほしいという訴えは、そのとおり全く同意できるものです。
2024.04.04
米国の DCIS 患者の多くは、将来に浸潤性乳がんまたは転移性がんを発症する可能性と、これらの望ましくない結果を回避するためにどうしたらいいのか、化学治療やホルモン剤をするかどうか、選択肢について混乱しているという報告があります。
DCIS の治療目標を明確にします。
第一には その後に発生する浸潤がんを予防することです。
第二の目標は、対側がん、遠隔再発、乳がんによる死亡を予防することです。
切除による治療後に 乳房内で浸潤性のがんが再発するリスクは、DCIS後と 浸潤性乳がん後で差がありません。
ウィメンズ カレッジ病院のデータベースでは、DCIS 後の 15 年間の浸潤性局所再発リスクは 15.6% でした。ステージ 1 の浸潤性乳がんの後では 15.3%、ステージ 2 の浸潤性乳がんの後では 15.9% でした。
患側の浸潤性乳がん発生のリスクを下げるための放射線療法のメリットも、 DCIS 患者とステージ 1 または 2 の乳がん患者で同様でした。Banting データベースでは、患側の浸潤性乳がん再発の 15 年リスクは、放射線療法を受けた DCIS 患者では 14%、放射線療法を受けなかった DCIS 患者では 29% であり、その差は 15% でした。対側に浸潤性乳がんが発生するリスクは、DCIS 後も浸潤乳がん後も同じです。
これらの研究と NSABP 試験から、乳房切除術と放射線療法によって、 DCIS と浸潤がん、両方の局所再発を全く同様に予防するが、乳がんによる死亡は予防できないことを学びました。
乳房切除術、放射線療法、または両側乳房切除術の最終的な利益は、DCIS の女性にとっても、早期浸潤がんの女性にとっても同じであると思われます。では、局所的な治療は同じであるのが合理的ではないでしょうか?
目標1 その後に発生する浸潤がんを予防する それは患側の再発、対側のがんの発生を含みます。
まず患側の浸潤がん(ここではDCISとは異なり、転移する能力を有するがんという意味です)も、対側のがんも、DCIS患者さん、Stage Iの浸潤がん患者さん、そしてStage IIの浸潤がん患者さんで差がないことを示しました。
目標2 対側がん、遠隔再発、乳がんによる死亡を予防する
たしかに全摘する、放射線治療をすることで、患側局所の再発は予防できます。しかしそれはDCIS患者さん、Stage Iの浸潤がん患者さん、そしてStage IIの浸潤がん患者さんで差がありません。そして全摘をしても、放射線治療を付加しても、つまり局所治療を徹底しても、乳がんによる死亡は抑制できませんでした。
それならば Stage 0のDCIS、Stage Iの浸潤がん、Stage IIの浸潤がんで治療方針が異なることはおかしいといえます。少なくともここで示した局所に対しての治療(手術、放射線治療)の方針は同じであるべきです。
DCIS 後の乳がんによる死亡を減らしたい場合は、DCIS 発生時、または局所浸潤性再発時のいずれかに全身療法を施すことを検討する必要があります。タモキシフェンには生存上の利点があるかもしれませんが、私の知る限り、DCISに対するタモキシフェンの死亡率の抑制効果は現在証明されていません。タモキシフェンはがんの発生そのもののリスクを軽減しますが、がん死亡率に対する効果はまだ確認されていないのです。
DCISによる死亡の平均リスクは0ではありませんが大変低いものです。実際には3から6%とされます。それを予防するために全身療法、特に抗がん剤による治療を付加しても、メリットを受ける人はどう見積もってもDCIS患者さんの20人に1人に過ぎず、化学治療ですべての再発が防げるものではありませんから、その数字はさらに低いものになります。副作用が強い抗がん剤使用を正当化するには低すぎます。
しかし将来の死亡のリスクがはるかに高い(たとえば12%)DCIS患者のサブグループを特定できたらどうなるでしょうか? そうすれば化学療法は正当化されるだろうと主張する人もいるかもしれません。
Mannu Dr.らは、検診発見されたのではないDCIS症例は、検診で発見されたDCIS症例よりも死亡リスクが驚くほど高いことを指摘しました。(検診発見された DCIS の女性の20年後における死亡率は4.4%、それ以外の方法で発見された DCIS の女性では 6.1%)
Mannu GS, Wang Z, Dodwell D, 他:英国における1990年から2018年までの浸潤性乳がんと非スクリーニング検出後の上皮内乳管がんによる乳がんによる死亡:人口ベースのコホート研究. BMJ 384: e075498, 2024.
死亡率が上昇する危険因子には、それ以外にも、診断時の年齢が若いこと、黒人人種、病巣が多いこと、微小浸潤、腫瘍サイズ > 25 mm などがありました。
若い黒人女性の間で、DCIS により死亡するリスクは 10% に近づきます。 Mannu らの研究では、45 歳未満で診断された患者の 25 年間の乳がん死亡リスクは 7.6% でした。
筆者から
このコラムでスティーブン・A・ナロッド医学博士は、「私は、まだ DCIS から「がん」という言葉を取り除くべきではないと思います」と結論付けています。
私自身は DCISの患者さんで局所再発は何例も経験していますが、それによる死亡例はほとんど経験していません。
温存にせよ、全摘にせよ、術後の乳房や皮膚に再発病変が発見された時、それがDCISであることはほとんどなく、ほぼ浸潤がんの形式をとっています。それがいわゆる最初の治療の”取り残し”なのか、それとも新しく発生したがんなのかは確定する方法がないため、いつも悩みの種でした。今回 Mannu先生の論文は20年の経過観察からですから、10年以上たって術後の乳房にがんが出てきても再発とは考えない先生も多いでしょう。
ただそういった局所再発が発生する確率がDCISでも浸潤がんでも差がないのだとしたら、少なくとも浸潤がんで建てられる治療方針と DCISでの治療方針で差が有ってはいけないでしょう。浸潤がんを温存切除したら放射線治療を加えるのなら、DCISもそうするべきです。大きな浸潤がんは温存切除の対象にならないなら、大きなDCISも全摘するべきです。
DCISの手術後に、浸潤がんとして再発すれば、浸潤がんとして必要なホルモン剤、抗がん剤など、全身治療を加えるべきです。ただ他臓器への遠隔転移として再発すれば、もはや治癒は望めません。私自身はDCISから、浸潤がんでの局所再発を経ることなく、いきなり遠隔転移をきたした患者さんの経験はありません。ただMannu先生によれば、DCIS治療後の死亡例は意外にも多いことが示されています。当然、DCIS後に局所再発を経たにせよ、経ていないにせよ、最終的には遠隔転移をきたし、亡くなったということになります。
DCIS後に、補助的に全身治療をすることは賛成できません。
しかしもし局所に浸潤がんで再発をきたした場合は、DCISの経過は関係なく、浸潤がん、それも警戒をようするものとして治療は全力を尽くすべきと言えると思います。やはりがんはがんだ、という考え方に賛成します。
2024.04.04
上皮内乳管がん(DCIS)の女性を手術または放射線療法で治療する必要性についてはまだまだ多くの議論があります。上皮内がんは以前にお話しした乳管内乳頭腫と同じで、病変が粘膜内にとどまっており、他臓器に転移しません。したがって理論上はその診断が正しい限り切除してしまえば根治します。
わざわざおいておく必要もない、切っておけば安心だ。
私もそう考えていました。ただ乳管内乳頭腫のところでも触れましたが、乳管内乳頭腫の97%はそのまま安定しており、しかもその1/4は自然消滅してしまう、となると考え方は揺らぎます。
もちろん病理学にのっとり、病理のDrが診断する限り、乳管内乳頭腫は”良性”であり、DCISは”悪性”です。がん、悪性とはどういうことか。がんの定義は”無限に増殖する細胞によって構成された腫瘍”です。けっして”転移する”、放置していれば”命を奪う”腫瘍、と定義されているものではありません。増殖する、だけです。
一生かけて 1mmが2mmに増殖しつづけても(証明できないでしょうが)がんということになります。そのまま気づかずに一生を終えるでしょうが、それでもがんはがんです。
DCIS 患者が早期浸潤性乳がんの女性と同じように治療されていることは、多くの人を当惑させています。 より早期、Stage Iではなく、Stage 0なのに治療方針に現状差がない。DCIS 患者の多くは両側乳房切除術を受けています。
逆に差をつけようとして、術前にDCISと診断されていても、たとえばセンチネルリンパ節生検を施行し、切除標本で断端を標本全体にわたって観察し、 手術や放射線療法を避け得る可能性がある、リスクが十分に低い女性を特定するために多大な努力が費やされています。
Mannu Dr.らは、英国におけるDCISの女性の、最近の乳がん死亡率を追跡調査しました。そして術後20 年時点での死亡率が驚くほど高いことを発見しました。
検診発見された DCIS の女性の20年後における死亡率は4.4%、それ以外の方法で発見された DCIS の女性では 6.1% でした。
そしてその乳がん死亡率は外科的アプローチ(つまり全摘か、温存なのか)によってほとんど変わりませんでした。乳房切除術で治療された患者は、たしかに浸潤性再発がはるかに少ないという結果が出ましたが、乳房切除術で治療された患者と同様の死亡率を示しました。
スクリーニングで検出されなかったDCISの女性22,753人のうち、25年間の乳がん死亡率は、乳房切除術で6.5%、乳房切除術と放射線治療で8.6%、放射線治療なしの乳房切除術で7.8%でした。
上皮内乳がん (DCIS Stage 0)の患者さんであっても、20年間観察すれば4~6%の確率で亡くなっていることは驚きです。
それは手術で取り残しがあったということを考えなければ、DCIS全体で4~6%は上皮内癌ではなかった、転移を起こす浸潤癌だった、ということになります。病理学的な過小評価です。
でもだからこそ全摘すべき、切除すべき、とはなりません。というのも乳房全摘する、温存して放射線治療する、温存して放射線治療しない、その3つの選択肢の間で成績に差がなかったのです。治療レベルを上げても成績に差がない、それはどういうことか?
手術や放射線など、切ったところだけ、当てたところだけに影響する治療法を局所治療と言います、逆に抗がん剤や、ホルモン剤など、全身に影響を及ぼす治療を全身治療と言います。局所治療によって差が出ない、それはがんが命をうばうときはほぼすべて転移が関係していることにあります。つまりすでに乳腺から出ているのです。だから局所治療では差が出ない。
DCISの 4~6%は過小評価されており、浸潤がんであり転移能力があります。ただその場合、治療をされた時点ですでに転移は達成されており、局所をどれだけ頑張っても治療成績には差が出ない、そういう意味になるのです。
ではDCISにホルモン剤をする?抗がん剤をする?
このコラムをかいたスティーブン・A・ナロッド医師はそこに触れていきます。
これまでのところ、DCIS 治療研究における私たちの焦点の多くは、放射線療法を回避できる再発リスクが十分に低い患者のサブグループを見つけることです。治療を省略、緩和すること目標に定めることはもちろん素晴らしいですが、それで命が犠牲になる方多いのでは話になります。そういう方が最終的に浸潤がんで死亡するのか、それを特定するためにもっと努力する必要があると思います。
では乳がんによる死亡リスクが 12% 以上である DCIS 患者を最初に特定できた場合、こうした患者さんに化学療法の施行を検討するのは合理的でしょうか?
私を困惑させているのは、そもそも温存切除術を受けた患者の方が、乳房切除術を受けた患者よりもなぜ成績が良くないのかということです。DCIS 患者は通常術後補助化学治療は受けておられません。
もしその後に局所再発が認められた時には補助化学療法をどのくらいの頻度で受けているのでしょうか? DCISの切除後に、局所で浸潤がんで再発があった際には、補助的に化学療法をしておくべきと考えられます。効果的な治療法であると推測されています。
DCIS後の転移再発(それは当然発生した時点で転移能力がある浸潤がんであり、もはや上皮内がんではありません)や浸潤がんとしての局所再発は、救命のためには全身療法を提供する機会を逃してはならず、効果的な治療法であると推測されています。
乳房切除術を受けてDCISで死亡した女性は、通常、最初に局所再発ではなく遠隔再発を起こし、その時点で化学治療が行われています。しかし遠隔転移をきたしてからどんなに抗がん剤治療を頑張ったとしてもそれでは治癒は望めません。
DCISの患者さんが術後に補助的に抗がん剤治療を受けることは現状はない。
DCISの患者さんが、その後に局所再発(切除した皮膚や胸壁にがんが再び現れる)し、それが浸潤がんであった際には、抗がん剤をはじめとした全身治療を施行しておく必要がある。
転移をきたしてからでは治癒は期待できない。
2024.04.03
「乳がんと診断されました。病院に受診して、PETやCTなど様々な検査をして、やっと手術が決まったと思ったらさらに2週間待ちと言われました。診断されてからなら1か月も経っています。大丈夫ですか?PETでは転移はないと言っていただけたのに、この2週間で転移してしまったらと思うと、いてもたってもいられません。」
これはよく受ける相談です。私の施設で可能なのは診断までなので、手術や抗がん剤が必要となれば大きな専門施設へ紹介になります。すると上記のような相談をもって患者さんがよく帰ってこられるのです。
一つには、「では明日切ってあげる」という施設で治療を受けますか?ということがあります。
家を建てるとき、いろいろな工務店やハウスメーカーに相談するでしょう。いろいろプランを立て設計し、着工となれば3か月はみておいてください、と言われた。ところがある工務店に行くと、わかりました、明日から着工します、お金は後から請求します、と言われたらどうですか?警戒するでしょう?
家と一緒にはいかない、それはそうです。命は何より大切ですから。
ただ、だからこそより慎重に、そして準備に関してよりしっかりしておくことが当然なのではないですか?むしろ逆でしょう。
先日も同じ相談を受けました。
ここでそこでその患者さんにした回答を紹介させていただこうと思います。

検査が終われば、治療は1日でも早く始めていただいた方がいい。これはその通りです。
検査で必要な時間と日にちは仕方はないですが、それが終わってしまえば治療方針はたっているのですから早く始めていただいた方がいいに決まっています。
実際 診断から治療開始まで、2週間以上かかると治療成績に差が発生するとした論文もあります。
Zhu S, Li S, Huang J, Fei X, Shen K, Chen X. Time interval between breast cancer diagnosis and surgery is associated with disease outcome. Sci Rep. 2023; 13: 12091.
ただ、5mm以下の早期がんがそれから2週間で進行するのと、2cmを超える乳がんがそれから2週間で進行するのには大きな差があることでわかるように、またがんの進行速度には差があることも知られており、2週間という期間がその患者さんにとってどれくらい重いものなのかは差があります。あくまで一般論として、検査で必要な期間でない限り、治療の待機時間は短ければ短い方がいいのは当然です。
そしてそれが患者さんの不安につながるのも事実です。
それを踏まえて私がした回答です。
参考にしていただければ幸いです。ただ個人を同定できないように実際とは多少変更しています。
******************************************
「お話しを要約すると、現在のAさん(80歳)の乳がんは cT1c(14mm) N0 M0 Stage 1である、つまり早期癌ということになります。
ホルモンレセプター陰性 HER2 陰性でトリプルネガティブ乳がんとされている。乳がんの中では比較的悪性度が高く、注意が必要だと聞いておられる。細胞分裂指数も高いと聞いた。
2週間後の手術予定だが、現在はリンパ節転移がない、早期癌の範囲にとどまっていると言われているのに、その間に転移してしまったら台無しになる。そういう相談ですね。
現在Aさんの乳がんは14mmとされています。これはマンモグラフィー、超音波検査、MRI、どれで測定したかによって少し値が異なると思います。検査時期ではMRIが最後になっていることが多いと思います。MRIはたいていUSより大きく見えるので、MRIでサイズが大きく計算されたとしても、実際にがんが大きくなったとは言えません。
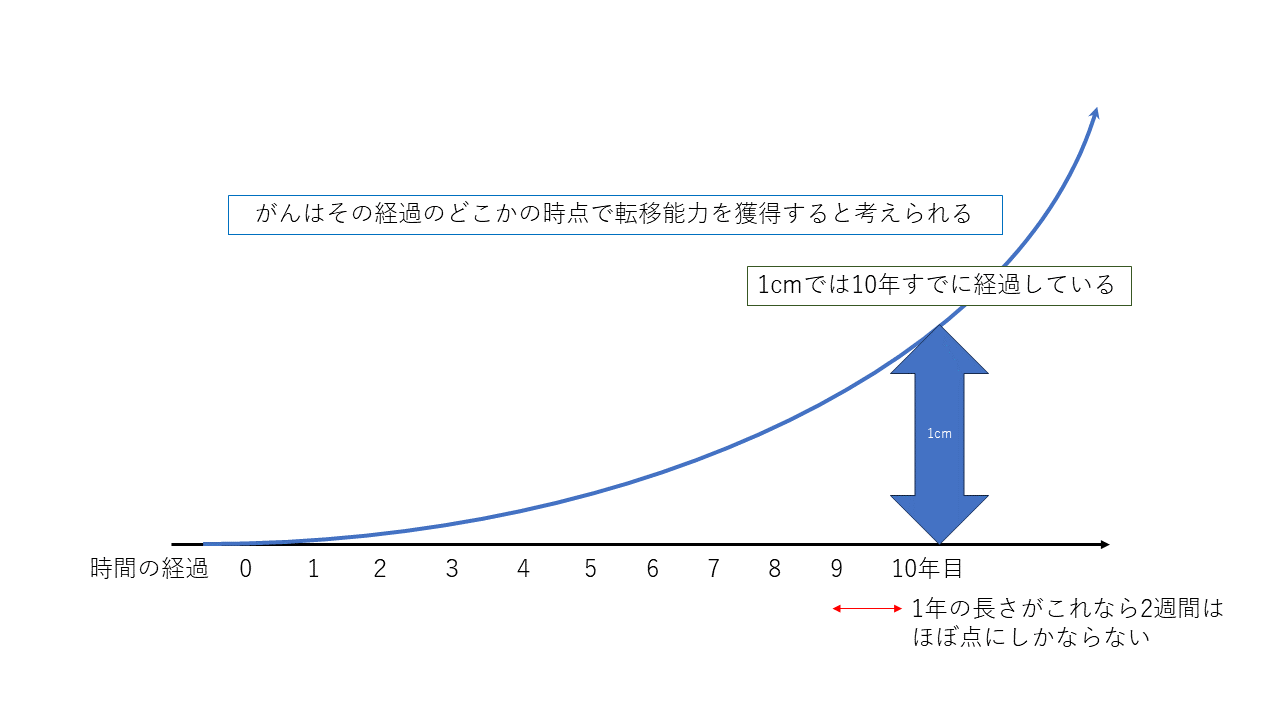
さて乳がんでは腫瘍が10mmに達した時点で癌細胞はすでに10億個存在しているとされます。
癌細胞1個が2個になるのに3ヶ月程度と言われています。
細胞は23回分裂すると10億個になるので1cmになるのに最低でも23×3ヶ月で69ヶ月です。
つまり癌細胞が1個発生してから5年、60か月以上経過していることになります。実際には1cmに達するまでに10年と言われています。
10年の経過からすればこの2週間はあまりに短く、誤差範囲でしょう。
がん細胞は、そのすべてがリンパ節などの他の臓器に転移する能力を持っているのではありません。最初から持っているものもいますが、その多くは分裂して増えているなかで転移する能力を獲得していくと言われています。
がん細胞の数が増えれば増えるほど、転移能力を獲得する個体が出現する確率は増えますので、どの癌もいずれは転移する能力を獲得します。もちろん大きくなればなるほどがん細胞の数も多くなるので確率は増えます。
それでもそれがこの2週間に限定して起こることはまず考えなくてもいいでしょう。
転移しているものなら、検査して、転移はないとされてももう転移していると考えるべきです。もし本当に検査通りに転移していないのならこの2週間で起こる確率はほぼ無視できるほど小さいのです。
図を書いてみました。参考にしてみてください。
それを考えれば、この2週間を恐れて無理矢理に予定を変更してもらったり、まして病院を変えたりすることはむしろAさんに不利に働くことはあっても有利に働くことなどない、といえるのではないでしょうか?」
トリプルネガティブ乳がんはリスクが高いので抗がん剤が必要となることが多い。でもAさんは高齢なので抗がん剤は難しいと言われてしまった。それならばなおさら手術を急いでほしい。
「わかりました。抗癌剤ですが、年齢を考えれば確かに投与は難しいでしょう。
乳癌は、末期がんと診断されてから、平均4年前後で死に至ることが多いとされます。もちろんAさんは末期がんと診断されていません。現状では早期がんと診断されています。
これからの経過の中でもし再発して末期がんと診断されたらの話です。それはあり得たとしてもまだ先でしょう。乳癌の再発は平均すると3-4年目に多く発生するとされます。そしてそれから4年間は平均生きられると申しているのです。すると最悪のシナリオを考えてもあと7年生きられます。
するとAさんは87歳になられています。日本人の平均寿命は女性で87.74歳です。
再発する最悪のシナリオを考えてもほぼ寿命を全うされています。それを考えればもしかして年齢的にそれで命を落とすかもしれない強力な抗がん剤を強行することは本末転倒です。
手術に先行して抗がん剤を施行することがあるのは知られています。手術の待ち時間が長いなら先に抗がん剤をしてもらう、それは選択肢ではありますが、Aさんの年齢からはリスクはあっても有利とはいえません。
先に手術をし、これ以上は進まないようにしておいて、リンパ節転移の有無を確定させてから、抗がん剤が必要かどうか、それから改めて治療方針を再検討する方が得策でしょう。
こうして考えていくと、主治医は至極まっとうな判断をし、最善の治療を提案されていることになります。説明も別紙を参照させていただく限り省略せずにキチンとされていました。信頼してついて行っていだけるのではないでしょうか?
以上、昨日は整理しきれなかったことを文面でお伝えしました。
また元気でお会いできることを祈念しております。」
ご予約専用ダイヤル
079-283-6103