先日 Youtubeを見ていて、恐ろしいことを述べている投稿に目が留まりました。
その内容というのは、
1 米国では40歳以下のマンモグラフィ検査は”禁止”されており、施行すれば逮捕される。
2 それくらい被ばく量の多い検査であり、大変危険な検査である。
3 最近になって乳がんが異常に増加している原因、それはマンモグラフィ検診の普及によるものなのだ。
こんな恐ろしいことをいう方がいるのか、と正直震えました。
全て”うそ”です。
まず私のブログを読んでおられる方であれば1については理解できると思います。
40歳以下(未満ですが)に施行しない、75歳以上に施行しないのは、「施行による死亡率の減少効果が認められなかったから」です。つまりやっても意味がないからしないのであって、禁止もされていなければ、逮捕もされません。事実、米国では25歳以上の女性には、乳がんのリスク評価を行い、必要であれば施行する制度ができています。被ばくが問題ではない、とは言いませんが、被ばくというデメリットと(というよりもコストや時間、乳がんでもないのに乳がんの疑いとされて精査をされる偽陽性の存在などのデメリットを強調していますが)、乳がん死の減少というメリットのバランスが40歳以下では取れていないのでしない、ということなのです。これについては何度もここで触れてきました。
米国予防サービスタスクフォース(USPSTF)が乳癌検診に関する新しい草案勧告を発表しました。
最近、医師がYoutuberとしてSNSに参戦し、その専門知識を使ってさまざまなコンテンツをアップロードしていますが、さすがに自分の医師免許をアップロードしているところは見たことがありません。そのYoutuberがコンテンツの中で自身が医療に携わっていると言っているだけです。証明はされていません。さすがに偽医師はいないでしょうが…
Youtubeは規制がほぼなく、コンプライアンスが既存のメディアに比べて緩いことが魅力でもありますが、少なくとも医療に関することを、資格のない方が一般の方に影響を及ぼす形で発信していることには問題があるように思います。特にこうしたSNSコンテンツではインパクトがないと再生してもらえないため、サムネと言われる”表紙”で衝撃的な内容を書いておいて、中身を見ると違うことを言っていることもよくあります。今回はしかしその通りの内容だったので驚きました。ほぼすべてうそを本当らしく事実と絡めながら述べていました。
2のマンモグラフィの被ばく量について改めて解説します。
1. マンモグラフィ検査: 被ばく量:0.1~0.5 mSv(ミリシーベルトと読みます)
特徴:乳房に対するX線撮影で、低エネルギーのX線を使用。
乳がんの早期発見に有効。被ばく量は比較的少ない。
2. 胸部X線写真(一般撮影):被ばく量:0.02~0.1 mSv(通常は約 0.05 mSv)
特徴:肺や心臓の状態を評価するための一般的な検査。
被ばく量は非常に少なく、通常の生活で受ける自然放射線(年間約2.4 mSv)のごく一部。
3. CT検査
被ばく量:胸部CT:5~7 mSv
被ばく量:腹部CT:8~10 mSv
被ばく量:頭部CT:2~4 mSv
全身CT(フルボディスキャン):20~30 mSv
特徴:X線を用いた断層撮影で、詳細な画像を取得可能。
一般撮影より被ばく量が多いが、診断価値が高い。
4. PET検査(PET-CT):被ばく量:5~25 mSv(PET単体:約5 mSv、PET-CT:約10~25 mSv)
特徴:放射性薬剤(18F-FDG など)を体内に注射し、がんや炎症などを検出。
CTと組み合わせたPET-CTでは被ばく量が増加。
まとめ
胸部X線やマンモグラフィは被ばく量が少なく、安全性が高い。
CT検査は部位によるが、胸部・腹部CTは比較的高い被ばく量になる。
PET-CTは放射性薬剤とCTを併用するため、被ばく量が高くなる。
これでわかるように、マンモグラフィの被ばく量は決して高くありません。胸部X線と比較すれば高く感じますが、胸部X線検査は1枚で終わりです。受けたことがある方は知っていると思いますが、マンモグラフィでは右側で2枚、左側で2枚とることもあるので、その分高くなります。ただ当然乳腺だけにできるだけあたるように絞って行われているので、左右別々に取る必要があるのです。CTではそんなことはしませんよね。
ちなみにミリシーベルトという単位について少し解説します。
ミリの部分は1mシーベルトは、1シーベルトの千分の1という意味になります。
シーベルト(Sv)は、放射線が人体に与える影響(生物学的影響)を評価するための単位です。
1. 放射線の基本単位
放射線に関する単位には以下の3つがあります。
グレイ(Gy) は「1 kgの物質が何ジュールの放射線エネルギーを吸収したか」を示します。
シーベルト(Sv) は「放射線の種類と人体への影響を考慮した線量」です。
1 Gy = 1 Sv ではなく、放射線の種類によって異なります。
ベクレル(Bq) は「1秒間に何個の原子が崩壊し、放射線を出すか」を示す単位です。
このようにシーベルトは、人体への影響を評価するために使われ、以下の基準があります。
| 被ばく量(mSv) | 影響 |
|---|---|
| 0.05 | 胸部X線1回の被ばく |
| 1 |
年間の一般公衆の被ばく限度(人工放射線) |
| 2.4 | 世界の自然放射線の年間平均 |
| 10 | CT検査(腹部)の被ばく量 |
| 100 | がん発生リスクが増加する可能性があるレベル |
| 1000(1Sv) | 急性被ばくで一時的な白血球減少 |
| 4000(4Sv) | 50%の人が死亡する可能性(致死線量) |
このようにシーベルト(Sv)という単位は被ばくの影響を表す単位であり、1Sv浴びればその場で強い悪影響があります。治療で1Svも浴びることはあり得ないので、ミリつまりその1000分の1の単位で被ばく量を表します。マンモグラフィは高く見積もっても0.5mSvですから、生活しているだけで環境から浴びてしまう自然放射線量の1/5程度ということになります。私がみたYoutubeコンテンツでは胸部X線写真と比較していましたが、胸部X線検査は検診だけでなく、肺炎や気管支炎などの診断や、治療効果の判定にも使います。1週間で3-4回施行することもある。撮影する対象も違いますし、目的も違う。比較することが根本的におかしい。
大袈裟に見えるようにあえて被ばく量のもっとも少ない検査をもってきて、比較してみせているだけのように思いました。

最後に、「最近になって乳がんが異常に増加している原因、それはマンモグラフィ検診の普及によるものなのだ」の部分です。これが最も劇的で、逆説的で、そして都市伝説的で、目を引く文章になると思います。しかしこれが完全に嘘なのです。
まず乳がんが異常に増加しているのは、”最近”と書かれていますが、これはいつからのことを”最近”と言っているのでしょうか。
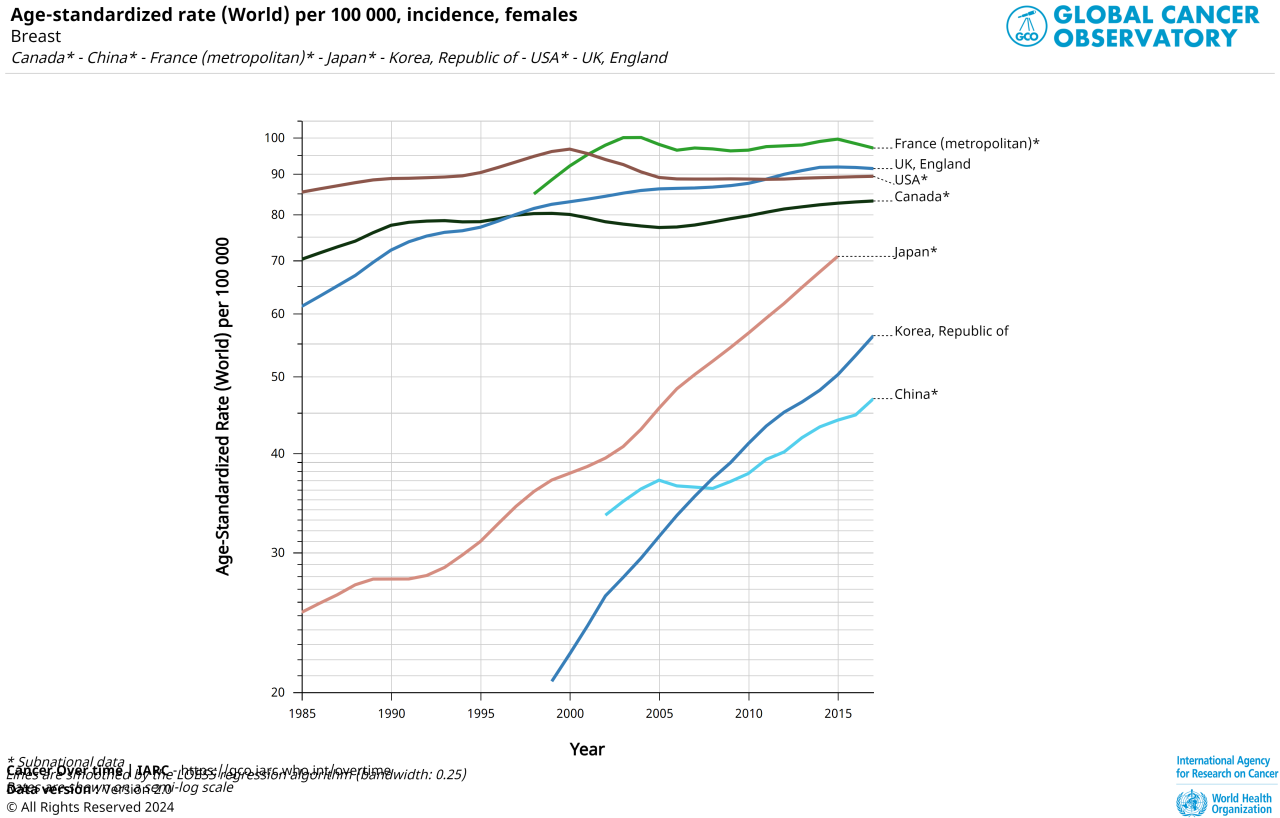
上記のグラフはWHOで公表されている人口10万人当たりの乳がんの罹患率の推移を示したグラフです。わが国の罹患率は下から3番目、急激に右肩上がりのオレンジ色ですが、ほぼずっと上昇傾向です。
上で固まっている中のえんじ色がアメリカ、濃緑がカナダです。
マンモグラフィ検診の日本での導入時期は1999年(本格導入)です。1980年代から試験的に導入されていましたが、正式な「対策型検診」として採用されたのは1999年です。2000年に厚生労働省が「乳がん検診指針」を改訂し、40歳以上の女性に対して2年に1回のマンモグラフィ検診を推奨したのが始まりです。
アメリカ(米国)では導入時期は1970年代~1980年代(普及)です。1960年代後半からマンモグラフィの技術が発展し、1970年代には一部で乳がん検診に活用されるようになりました。1980年代に入ると全米で本格的に普及し、1989年には米国予防医学タスクフォース(USPSTF)が推奨を始めています。カナダでは1988年に全国プログラム開始で導入されています。
グラフでわかりますが、日本での乳がん罹患率は検診が始まる1999年より前から上昇しています。
またマンモグラフィ検診が原因なら米国や、カナダで同じような上昇が認められ、それが10-20年前倒しで起こるはずですが、それは認められていません。
乳がん罹患率が上昇しているからマンモグラフィ検診が導入されたのです。それを逆に解釈するのはあまりにも悪意に満ちたひどい解釈です。
ではなぜ乳がんがこれほど増加しているのか、それも私のブログの中で触れています。もちろん一つの要因で説明できないことはあるでしょうが、この説は京都大学の研究で裏付けられたものです。よかったらこちらも参考にしてください。
なぜ乳がんは増えているのか ついに学問的に説明できてしまった?
コロナワクチン以来、陰謀説の花盛りの時代です。いつの間にか根拠のないうわさが独り歩きし、時に誤った認識を広めることでうわさが害をなすこともあります。皆さんも、オールドもニューも、メディアのいうことをうのみにせず、自分で判断する目を養ってください。
それは私のブログに関しても同様ですけれどもね。
2025.03.14
乳がんに限ったことにはありませんが、がんの治療法は進化し続けており、常に新しい薬剤が開発され、時に画期的な発見によって、がんによる死亡率は年々減少し続けています。もちろんその進歩は止まることなく続いており、がん克服に向けて、世界中で優秀な医師、研究者が画期的な治療法や、薬剤を求めて日夜努力を続けています。
しかし乳がんに関しては、2010年ごろを契機にして、なぜかその傾向が止まってしまっており、とくに40歳未満および74歳以上の女性の乳がんによる死亡率が、それまでは長期にわたって減少していたにもかかわらず、低下が止まっていることが研究によってわかっています。
20歳から39歳の女性の乳がん死亡率は、1990年から2010年にかけて年間2.8%減少していました。しかし2010年から2022年にかけては減少が見られず、年間変化率は-0.01(P =0.98)と、ほぼ全く変化しなくなっている、と、テキサス州テンプルのベイラー・スコット&ホワイト・セントラル・テキサス画像研究教育財団の医学博士デブラ・L・モンティチオロ氏と、コロラド州オーロラのコロラド大学アンシュッツ医学部のR・エドワード・ヘンドリック博士が報告しました。
そして75歳以上の女性では、乳がんによる死亡率は1993年から2013年にかけて大幅に減少していました(年間変化率 -1.26、P =0.01)が、2013年から2022年にかけては減少の証拠は見られませんでした(APC -0.2、P =0.24)と、最新のJournal of Breast Imaging誌で指摘されています。
40歳、74歳という年齢におけるキーポイントがあるように見えます。これは米国の予防サービスタスクフォースと呼ばれる国の定めた委員会が、「マンモグラフィによる乳がん検診の対象年齢を40歳から74歳まで、隔年での施行を勧める」としたことに起因します。(参照)
研究者たちは、年齢制限を書けることの愚かさを、根拠を示してこのガイドラインに反対しようとしている、ということを背景として知っておくとより理解が深まるでしょう。
しかし、40歳から74歳の女性(つまりマンモグラフィ検診の対象年齢)の場合、乳がんによる死亡率は1990年から2022年にかけて年間1.7%から3.9%減少しており(P <0.001)、この年齢層ではアジア人女性を除くすべてのコホート研究で乳がん死の減少が観察されました。つまりこの年齢層では死亡率の現象は現在まで継続しています。
1990年以降乳がん死亡率が低下し始めたのは、マンモグラフィーによる検診の普及と、治療法の改善によるものと思われます。
米国予防医学タスクフォースが推奨するスクリーニング範囲である40~74歳から漏れてしまっている年齢層の女性では、長年改善が見られてきた乳がん死亡率が、もはや低下していないことが懸念される、と研究者らは記しています。これらの年齢層で進行期乳がんの診断率が上昇しているため、死亡率の低下が止まった可能性があると指摘しました。
(筆者注)恐ろしいのは40歳以下の若年層、74歳以上の高齢者層で、進行がんで見つかる割合が”増えている”傾向が認められているということです。我が国日本では推奨年齢は40歳から60歳のままなので、もしそれが事実なら60歳以上の女性で同じ現象が起こっている可能性があります。
今回の分析では、研究者たちは、1990年から2022年までの全女性、年齢層別、人種または民族別の国立健康統計センターのデータを使用しました。この期間に女性全体で乳がん死亡率は43.5%減少し、年間変化率は1990年から2010年にかけて年間1.66%から3.28%減少しました。しかし、2010年から2022年にかけては年間1.23%の減少にまで縮小しました。
(筆者注:ちなみにわが国では乳がんの死亡率は減少傾向は未だ認められていません:WHO参照)
人種や民族別に見ても、ほとんどのグループで1990年から2022年にかけて乳がんによる死亡率が低下していました。観察期間中に乳がんによる死亡率は、白人女性の割合は41.4%、ヒスパニック系女性の割合は30.3%、黒人女性の割合は28.8%、アジア系女性の割合は11.8%減少していましたが、ネイティブアメリカン女性の割合のみ10.1%増加しました。
しかし、最近に絞ってこの傾向を調べてみると、乳がんによる死亡率は、アジア系女性では 2009 年以降、ヒスパニック系女性では 2008 年以降、ネイティブ アメリカン女性では 2005 年以降、低下が止まっていました。さらに、75 歳以上のアジア系女性の死亡率は 2004 年以降上昇しており、年間変化率は 0.73% です。
筆者注:米国では高等教育で自己チェックの指導を行っています。確かに小学生や中学生の年齢層に乳腺の自己チェックの教育をしてもピンと来ないかもしれません。しかし社会の貧困層に属している女性ほど高等教育を受ける機会に恵まれておらず、よって学校からも、またそうした教育を受けていない親からも、乳腺の自己チェックの習慣づけがなされていない可能性が高くなります。
ここではそこまで触れられていませんが、私は、人種による遺伝的素因よりもこうした社会的背景の影響の方が大きいと考えています。
そしてそこから鑑みるに、高等教育においても乳腺の自己チェックを指導しておらず、親世代も現代の若年世代も、自己チェックの教育を受ける機会が全くない日本人では、特に40歳以下、60歳以上で乳がんによる死亡率が減少しないどころか上昇していることが予想に硬くありません。
勤勉で、言われたことはきちんと守り、継続できる我が国の女性たちがなぜ乳がんで苦しまなければならないのか。私は憤りすら覚えます。
1990 年代前半から中頃にかけて、白人女性と黒人女性の両方で死亡率が全年齢層で大幅に低下し、黒人女性の 年間変化率は -1.42、白人女性の年間変化率 は -1.05 でした。
しかし、乳がんによる死亡率は黒人女性の方が白人女性よりも高く、その比率は年齢によって異なります。2004年から2022年まで、黒人女性と白人女性の乳がんによる死亡率の比率は全年齢で1.39で(筆者注 つまり同じ乳がんに罹患しても、黒人は白人の1.39倍亡くなっています)、年齢層によって大きく異なります。20~39歳の女性では2.04、40~74歳の女性では1.51、75歳以上の女性では1.13です。
40歳未満の女性の間での人種間での死亡率の差は、「特に若い黒人女性では、現在の乳がんリスク評価、検査、治療戦略を変更しなければならない」ことを示唆していると研究者たちは指摘しました。著者らはまた、診察時の黒人女性と白人女性との比較でステージIVの疾患発生率を評価し、黒人女性と白人女性のステージIVの発生率比が死亡率比を反映していることを発見しました。(筆者注:つまり末期がん状態で発見される割合が、黒人の若年者女性では高いわけです。)
だから25歳から40歳の女性全てが乳がん検診をするべきと考えているのではありません。乳がんのリスク評価は25歳までにすべての女性に推奨されています(筆者注:日本ではそれを受けることができる窓口はありません。それもまた我が国の恥ずかしいところです)。40歳未満の女性の乳がん検診は、その評価において平均以上のリスクがある場合にのみ推奨されます、と筆者は述べています。
「私たちの研究結果は、若い黒人女性がよりタイムリーなリスク評価と診断を受けられるようにするために、さらなる取り組みが必要であることを示唆している」と研究者らは記しています。「特に少数民族については、医療格差を考慮する必要があります」と結んでいました。
筆者から: わが国ではまずマンモグラフィ検診が40歳から60歳までに推奨されています。しかし40歳より若い年齢に乳がんが発生しないわけではありませんし、60歳以上の女性においてはむしろ40-60歳女性よりも多く乳がんが発生しています。当然74歳まで検診を推奨している米国よりも乳がんによる死亡率は高くなることは予想に硬くありません。
40歳以下、60歳以上の方は、したがって自己チェックをしておくことが必須になります。自発的にマンモグラフィ検診をドックなどで受けられてもいいですが、きちんと定期的に受けられていなければ危険性は低下しません。米国では25歳以上の方は自分の乳がんのリスクをチェックしてくれる窓口があります。リスクが低い方では40歳以下でマンモグラフィ検診を受けることは推奨されていません。しかし残念ながらそれを相談できる窓口が日本では存在しません。そして高齢の方ではなかなか医療機関の受診が難しい方もおられる。これらの若年者、高齢者こそ、何も害がなく、どこでもできる乳腺の自己チェックを徹底するべきです。
しかしそれに必要な知識、つまり自己チェックの教育がわが国ではなされていない、という現状があります。残念ながら学校や行政にそれを期待できない現状がわが国にはあります。
私は、たとえばこのコラムを読んでおられる知識のある方、検診を受けておられる世代、そうした方が若い娘、高齢の親に声掛けし、乳腺の自己チェックを指導していくしかない、と考えています。
2025.03.06
本の内容について、少しずつ触れてきました。
あまりしつこいと、よほど売りたいのかなと思われてしまう、と思っていたのですが、「大事なことなので一度しか言いませんよ、という人よりも、何度でも繰り返し言います、という人の方が信用できる」という記事をFACEBOOKで見ました。勇気をもらってもう少し話します。
本当に売りたいのなら、あまり内容を話さないほうが本来いいはずですものね。私は本にして出すほど、もともとしつこい人間もありますし(笑)。
前回も書きましたが、当クリニックで発見される乳がんの内約半数は定期的に検診されていて、我々が「今回は異常がみとめられます」と言って発見します。もちろんその場合はほぼ早期で発見されます。最終的にがんである診断には医師による病理検査が必要なので、全ての乳がん症例がわれわれによって診断が決定しているのは確かです。ただ残りの半数の方は「先生、なにか硬いしこりがあるんです。痛くもかゆくもないんですが…」といって来院され、われわれが検査をして、乳がんの診断がつきます。この場合、発見したのは我々ではなく、やはりご自身です。そして現状ではほぼすべての施設で発見されている乳がん症例のほぼ半分は、残念ながら検診ではなくこうして自分で発見されたものなのです。
ただ当然ですがそうして発見された乳がん症例では原則早期がんから、残念ながら末期で発見されるものまですべてが含まれることになります。それはご自身がどれだけ注意して自己チェックしていたか、そして発見してどれくらいの期間経過を見ていたか、に左右されます。
注意して定期的にきちんと自己チェックしていた方ほど、より小さく、早期で発見されます。
逆に普段全く意識をしておらず、入浴時や下着をつけていて偶然気付きました、という方であれば残念ながら早期がんではない確率が上昇します。まして、別に痛くもかゆくもないので、という理由で放置され、数か月経過を見ていて大きくなってきたので慌てて受診した、そういった乳がんでは残念ながら早期で収まっていることは期待できないでしょう。
私は2年に1度 クーポンできちんとマンモグラフィで検診を受けています!
たしかにそれは大切だし、早期発見につながります。けれども2年に1回しか検診をしていない、とも言えます。きちんと日を決めて、正しいやり方で自己チェックをしています、と言われる方は毎月検診をしています。
もちろん両方をされているのが最善です。
単純な比較はできませんが、検診に携わっている人間である私にとって、この2つの乳がん検診を比較し、どちらかを選べ、と言われれば後者の方が優れています。
2年に1度の検診は、もしその年に住み慣れない土地に引っ越したりして、受ける機会を逸してしまえば4年開いてしまいます。万が一そこで乳がんが発生すればまず早期発見などできないでしょう。
しかし毎月自己チェックを習慣にされている方ではそれがない。入浴を4年もしない方はいないと思われるからです。もちろんたとえ入浴できなくても自己チェックはできます。どこでもいつでもできるからです。どんなに仕事が忙しくても、育児が大変でも、妊娠されていても、高齢で動けなくても、医療施設のない島や田舎住まいの方でも、災害にあわれて避難生活を余儀なくされておられる方でも思い出しさえすればできるからです。もちろん1円たりとかかりません。それでいて早期に発見された場合の治療にかかる経済効果は計り知れません。
習慣にしてしまえばこれほど頼りになる検診はないのです。また自分でチェックできるのがほかのがんにはない乳がんだけの強みでもあります。


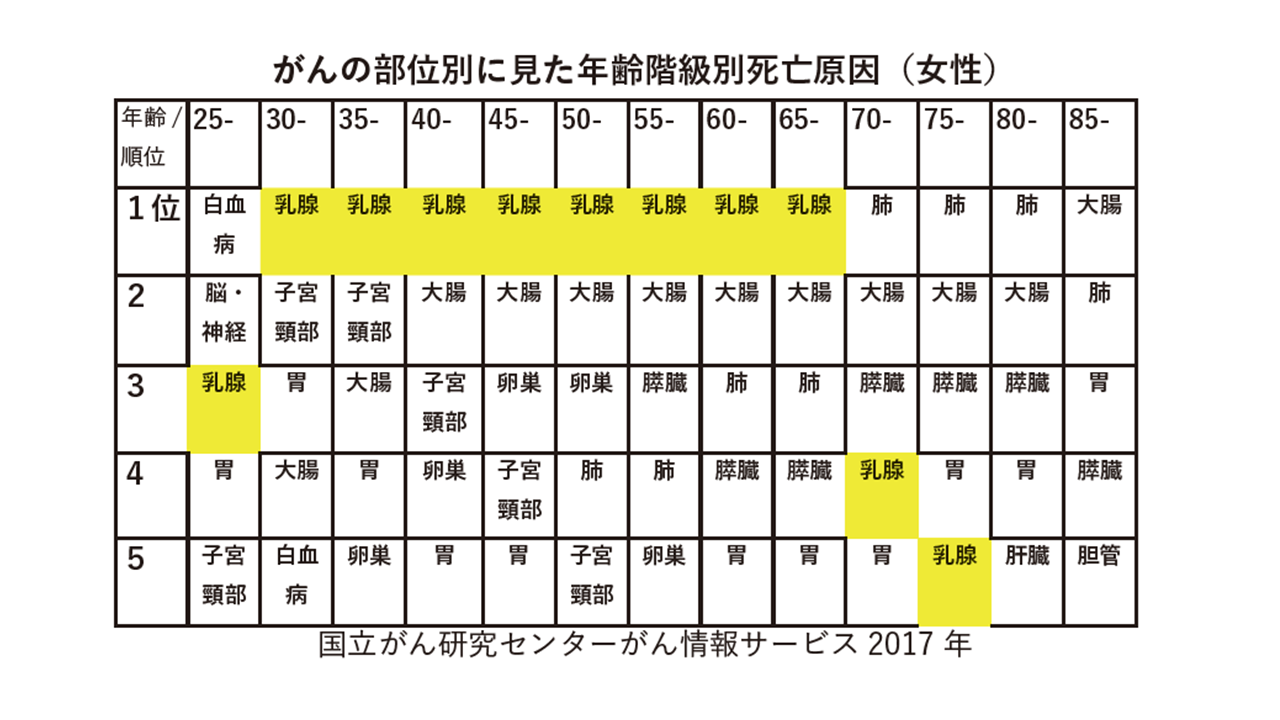
上の表は 日本の女性のがんによる死亡原因を年齢階級別にみたものです。
日本人女性のがんによる死亡原因で一番多いのは大腸がんであることはよく知られていますが、それは全体で高齢者を含めてみたときにそうなります。少なくとも30歳から70歳までの比較的若い女性で見たときには、死因の第1位は乳がんになります。
子宮頸がんは若い女性、特に20台30台では脅威です。しかしそれでも乳腺の方が上になります。
繰り返しますが、上の表は死因であり、罹患ではありません。がんになられ、亡くなっておられる方の順位を見たものです。少なくとも30歳代では乳がんは紛れもなくもっとも恐ろしいがんなのです。
そこで考えてほしいことがあります。
20歳代、30歳代でも確実に乳がんの方はおられます。そして不幸にして発見が遅れ、亡くなっておられる方もおられる。
20歳代、30歳代の方にはクーポンは来ません。ドックもまずいかないでしょう。
職場の検診のマンモグラフィも40歳からがほとんどですよね。
ではこうした若年齢者の乳がんはどうやって見つかっているのでしょう?
そう、自分で見つけているのです。自分で触っていて気づくしかない。
たしかに検診を受ければ、人間ドックを受ければ、早期で見つかるかもしれません。ただ検診は有料です。原則保険が効きません。20歳から毎年、規則正しく、お金を払って検診を受ける。気持ちがいいものでもないマンモグラフィ検査を受ける。ご自身に照らし合わせてください。まずやらないでしょう。
ではここで質問です。
小さいころからお風呂でお母さんが乳腺の自己チェックをしているのを見ている娘さん。お風呂にビー玉を置いてお母さんがチェックしていたら、娘さんなら必ず聞くはずです。
「お母さん、なにしているの?これなあに?」
これはね、乳がんのチェックをしているのよ。
「お母さん わたしは?」
いまはいいよ。でも大きくなったら必ずするようにしてね。
そうして育てられ、生理が始まったら自己チェックを習慣づけるように母親から言われて育った娘さん。
お母さんが自己チェックはもちろん、乳がんの検診などしていない。だから娘に声掛けなどしたこともない。注意もしない。そうしたお母さんに育てられた娘さん。
この二人の娘さんが不幸にして20歳代、30歳代で乳がんに罹患してしまったとしたら、発見が遅れて不幸な結果になる可能性が高いのはどちらの娘さんでしょうか?
これは聞くまでもない。そんなの分かり切ったことです。それを裏を返すと、こうした若年性乳がんで、残念ながら早期発見できなかったとしたら、不幸な顛末になってしまったとしたら、それは”親の責任”ということもできる。検診の対象にならない若い女性に、普段から、若い時から自己チェックをするように声掛けできるのは親だけだと思います。日常生活の場面場面で気を付けるように、たとえうるさがられても、言い続けることができるのも親だけだと思います。
その気持ちはある。ただどう教えたらいいかわからない。正しい方法がわからない。
だからこの本を書きました。
この本は、母へ娘へという副題がついています。これは、母へ(このことをわかってください。貴方だけが検診していてもだめだ、貴方の娘さんは大丈夫ですか)、(あなたの)娘へ(この本の内容を教えてください。検診に行かないまでも、定期的に正しく自己チェックをするように指導してください)という内容を込めているのです。

ご購入はここからどうぞ。別途送料がかかります。
歯磨きは親が子に教えて習慣にするもの、歯科検診は自分で考えていくようになるもの、です。
同様に 自己チェックは親が子に教えて習慣にするもの、クーポンをはじめとするマンモグラフィ検診や人間ドックは自分で考えていくようになるもの、です。
乳腺の自己チェックはしたがってすべての女性が日常で習慣としてするものです。
私の外来では、検診で来てくださった方の診察の中ではもちろん、待合室では私のビデオが流れていますし、このブログでも繰り返し、自己チェックをしてくださいとお願いしています。
ただ歯科検診を受診して、口頭で歯磨きをしてくださいね、とは声掛けしていただけると思いますが、正しい歯の磨き方を手取り足取り指導してくださる歯科医の先生はあまりおられないと思います。基本的に年に1,2回の指導では子供はきちんと磨くようにはなりません。やはり親の監視と指導があってはじめて習慣になります。しかも親に言われてやっているうちは本当の習慣ではありませんよね。自分からやるようになって初めて虫歯ができにくい環境が整います。歯磨きの指導は本来歯科医の日常の役割とは異なるのです。
私は乳腺の自己チェックもそれと同じで、乳がんの検診に自発的に来院されている女性に勧めていけば、きっと娘さんにも指導してくださるようになる、と考えています。それが今度は娘から孫に指導されるようになれば医師の役割は本来の役割に戻るでしょう。
ただ題名にあるように 「乳がんって自分で触っていたら本当にみつかるの?」という根本に疑問があれば、積極的にしようとは思ってくれないと思います。ただこの質問はあまりにも現状がわかっておられない質問なのです。
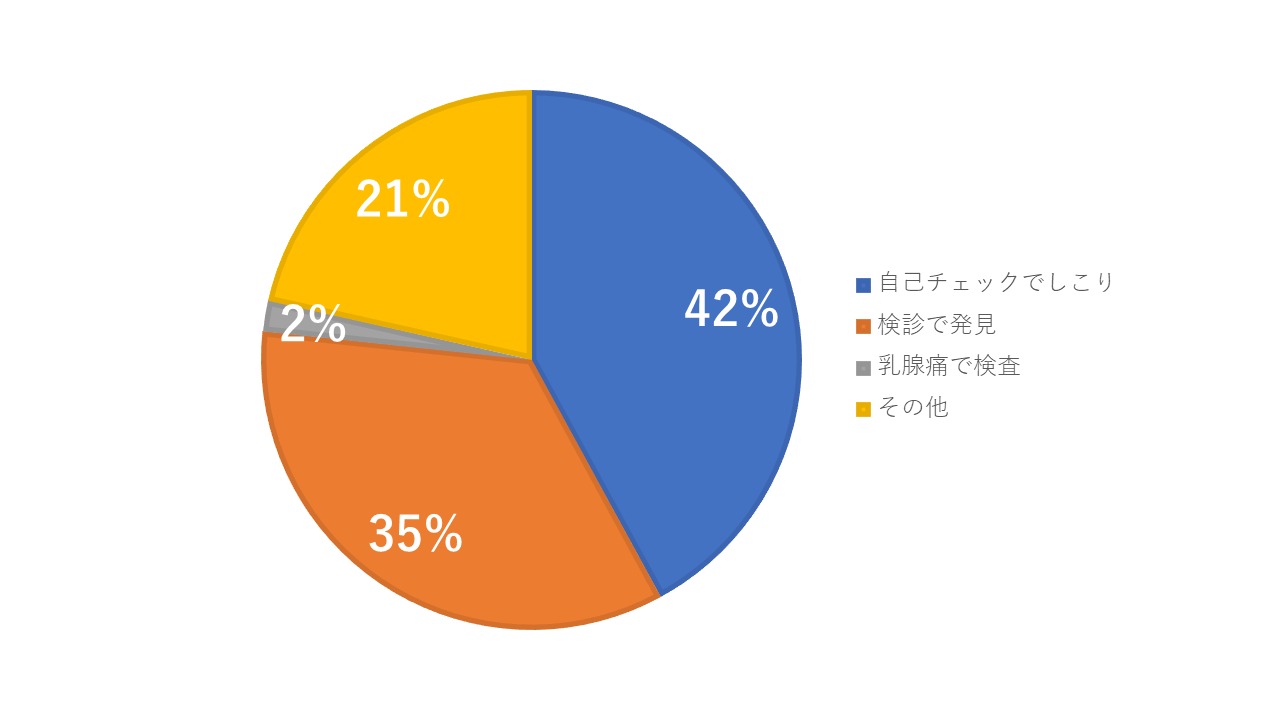
私の施設は年間2万人を検診し、大体200人強の乳がんを発見しています。
上の図はその内訳なのですが、昨年の段階でも残念ながら定期的に検診をされていて見つかった、あるいは他施設のドックや、クーポン検診で異常を指摘されて見つかった、そうした検診で発見された患者さんは35%です。割合から見て、最も多いのは自分で乳腺のしこりに気が付いて受診された、方です。
これはずっと変わりません。自己チェックでの発見はずっと1位で検診発見は2位です。すこしづつ2位が1位を追い上げていますが、まだ変わりません。
乳がんは自分で触って気がつくのですか?
「はい 乳がんの大部分は検診で見つかったのではなくて、自分で見つけられています。」
それが回答になります。

上の写真は、私の外来診察室においてある大小のビー玉と、ゴルフボールです。
右端の1.7㎝のビー玉が、私の本に付属しているものと同じサイズです。
「先生、乳がんって触っていたら本当にわかるんですか?」
これ(1.7cm)、自分の乳腺に当てて、想像してみてください。もしこの大きさで、この硬さのしこりが自分の乳腺に隠れていたら気づきますか?
「うーーん。難しいかな・・・」
そうですか?ではこの大きいビー玉(2.5cm)ならどうですか?
「いやこれは気づくでしょ。私の胸はそんなに大きくないし。」
そうですか?たとえば若い方が生理中や、生理前の乳腺が張って、痛みがあるような時ならどうでしょう?
「うーーん。そうですね・・・難しいかな。」
そう、だから自己チェックは痛みが気になったり、乳腺が張った時にするのではなくて、生理の間の乳腺が柔らかくて、張っていないときにしないといけません。娘さんに指導するときはそうしてください。ではこのゴルフボールならどうですか?
「これは論外ですよ。気づかない人いるんですか。」
そのとおり、乳がんを触って気が付かない人なんていないんですよ。乳がんに限らず、がんは必ず時間とともに進行して大きくなりますから。ただ、どの段階で気づくのか、それをできるだけ小さく見つけないといけないのです。自分で気づくにしても、検診で発見するにしても、早期で発見することが最も重要になります。自己チェックで気づくなら、この一番小さなビー玉が早期乳がんの上限になるのです。
できるだけ小さく見つけたい、小さい段階で気づきたい。
そのためには先に述べた生理前、生理中は避ける、など様々な注意があります。
自己チェックを行うのであれば、正しくやらなければどうしても発見が遅れるのです。逆に正しくやれば早期で発見することも可能になります。自己発見で見つかった乳がん患者さんでも、私のデータでは44%が早期発見されていました。
だからきちんとした知識を持って自己チェックをしなければなりません。
繰り返しになりますが、乳腺の自己チェックはすべての女性が、正しいやり方で規則正しく日常で習慣としてするものです。
そして自己チェックは親が子に正しいやり方を教えて正しく習慣にするもの、クーポンをはじめとするマンモグラフィ検診や人間ドックは自分で考えていくようになるもの、なのです。
前回の 自己チェックの”ポイント”を参考にしてください。ここで書いたことも本にまとめて書いています。よかったらご購入ください。
2025.02.14
わたしは 歯磨きは親が子に教えて習慣にするもの、歯医者は自分で考えていくようになるもの、と考えています。
同様に 自己チェックは親が子に教えて習慣にするもの、クーポンをはじめとするマンモグラフィ検診や人間ドックは自分で考えていくようになるものと思います。
乳腺の自己チェックは歯磨き同様に、すべての女性が日常で習慣としてするものです。
この本は乳腺の自己チェックのマニュアルです。やり方を説明しています。
この本は、様々な理由で施設で行われているマンモグラフィを中心とした市町村による対策型検診を受けることができない方、年齢が若い、あるいは高齢のために対象ではない方、検診に行かないで不安を抱えている方、そうしたすべての女性のために書きました。
施設を受診して2年おきに検診を受けておられる方、実はその方も対象です。
検診を受けているけれども、受けていない娘がいて不安だ、母親にも検診を受けてもらいたい、けれど年齢を理由に受けてくれない、こうした方も実はすべて対象です。この本の対象はすべての女性なのです。
一人でも多く、実行してもらいたい、そしてそれを一人でも多く、周囲の大切な人に教えて一緒に始めてもらいたい、そのためにこの本を出しました。ですので、この本を手に取ることが難しい方もぜひ始めてもらいたい。
この本の肝心のカナメをここに提示します。

この本の内容はこのページに集約されています。
このページを読まれて、この通りに実行してください。
そして直径が2cmよりも少しだけ小さなビー玉を手に入れて、それを胸に押し当てながら、まず自分が自己チェックを正しく、規則正しく始めましょう。
そしてそれができるようになったら、お母さんに、娘に、孫に、大事な人に、同じようにそのビー玉を手渡して、「生理後には必ず月1回は自己チェックをするようにしなさい。そしてもし自分の乳腺にこんな硬いしこりがあることに気がついたら、痛みがあるかどうかは関係ないんだよ。絶対この大きさになるまでに病院に行かなければいけない」 そう教えていただけるなら、この本を読む必要はありません。
これがすべてなのです。
あとはこれを補助する内容をまとめています。
下記にその項目を列記しましたが、その内容も、私のブログをずっと読まれていれば理解できます。目次から探していただいても見つかるかもしれません。
きちんと人間ドックや、市町村のクーポンで検診を受けていても、自己チェックは必要ですか?
なぜ毎年検診を受けていたのに、早期発見できずに進行がんで見つかることがあるのですか?
そもそもどうしてこんなに乳がんが増えているのですか?
乳がんは違和感や痛みを伴わないと言われますが、本当ですか?
自己チェックをしていたら本当に乳がんは見つかるのですか?まして早期で発見できるのですか?
もししこりに気がついたらどうしたらいいのですか?
これらについてその回答をする形でまとめています。これらは自己チェックを始める、その理由づけになればと思ってまとめた物です。短い本にするつもりでしたが、気づいたら、100ページを超える分量になっていました。
今 本当に乳がんに罹患される方は増えています。
そしてそれによって命を奪われてしまう方も非常に多い。しかし乳がんは自分でチェックできるがんなのです。今でも乳がんと診断される方の5割近くは結局自分で見つけておられるのです。
ただそのタイミングが遅いから、残念ながら進行して気づいているから、治療に難渋することになります。注意深く、正しく、規則正しく自己チェックしていれば、できるだけ早期で発見することは決して不可能ではないのです。
まずそれをご自身が理解して実践してほしい。そしてそれをできれば親から子へ、孫へ、伝えていってほしい。習慣として教えてやってほしい。そう考えてこの本を書きました。
もう一度 乳腺の自己チェックの必要性について、考え直していただけないでしょうか?

日本人女性の死亡原因を見たとき、もちろん1位は悪性新生物、がんです。
30歳代女性ではあればもう悪性新生物は不慮の事故による死亡率を上回って1位です。
そしてそれを1位に押し上げているのは乳がんです。30歳から70歳まで、がんの部位別に見た日本人女性の死因の1位は乳がんです。乳がんは自己チェックで検診できる唯一のがんであると言われます。日常生活で乳がんの自己チェックを怠ることは、日常で車を運転しながら注意を怠っているよりもよほど死に直結する、と言えるでしょう。皆さんも娘さんが車に乗るようになれば運転を注意するように声掛けするのではありませんか? しかし若い女性の死因から見るならば、その何倍も乳がんに注意するよう声掛けしないといけない。がんに関心がある親世代が、関心のない娘に声掛けしないといけない、私はそう思います。
しかし特に若い女性は仕事、家事、子育てと忙しい。まさか自分が乳がんになるなどと思ってはいない。
皆さんは若い女性が乳がんに罹患すると助からない、そんなイメージがありませんか?
それは進行が速いから、ではありません。高齢の女性でもがんの進行は早い。60歳女性でも死因のトップは悪性新生物です。若い女性でも乳がんが早期発見されればがんはきちんと治ります。同じ早期がんで比べてみるならば、その治癒する確率に年齢による差はほとんどありません。若い女性の乳がんが多く致死的である理由、それは発見が遅れがちになるからです。
「日常生活の中で乳がんに注意して、自己チェックすることを習慣にしなさい。」
親なら娘にそうして欲しいですよね。しかし習慣づけほど難しいものはありません。
乳がんの自己チェック、それはどうやって教えればいいのだろう。どう教えたらしてくれるんだろう。
そしてその正しい方法ってどうやればいいんだろう。
そもそも肝心の母親がそれを知らなかったり、自身がしていなかったりします。というよりも医師や公的機関から、正式に習ったことはないのではないですか?
私は日常で乳がんの検診に従事する乳腺の専門医です。診療を通じてどう自己チェックを指導すればいいか、どうすれば皆さんが実践してくれるか、様々に工夫しながら何年も模索してきました。そして、これで最善ではないか、という指導方法を確立しました。今 1日に200人近くが検診に来てくださっている当クリニックで実際に行っている指導内容を詳細にまとめたもの、それがこの本になります。


実はこの本には サイズにこだわって選んだビー玉が2個付属しています。
そうです。このビー玉が私たちが行なっている指導方法の鍵になります。
外来診療で様々な女性に自己チェックを勧めて行く中で、大きな問題点が二つあることに気づきました。
一つは習慣づけの難しさです。例えば歯磨きは医者が年に1回程度教えても身につきません。虫歯になって痛い目にあってだんだん身につく。それではガンの場合では遅いですよね。
朝起きたら顔を洗うように、寝る前に歯を磨くように、規則正しく、定期的に乳腺の自己チェックをする習慣を持っている、そんな娘さんになってほしくないですか?
しかし 習慣づけには親から娘への根気強い指導がなされる必要があります。できれば幼少期から、母親が自己チェックをしている姿を見せてほしい。そしてそれを年頃になったら指導してほしい。そうしなければなかなか習慣づけはできない。これは娘を持っておられる方にその話をすればすぐに理解していただけます。
こうして自己チェックを親子で始めるモチベーションが生まれたとして、最大の問題は、親がしたことのないものをどうやって子供に教えるのか、です。具体的な方法論が親にないのです。それが二つ目の問題であり、最大のものです。
そこでこの本が必要になりました。
この本には1.7cmのビー玉が2個付属しています。(もちろん本を買わなくても、同じサイズのビー玉を買っていただければ、とりあえず始められます。そして始めてください。)
これ、触診で気づいて欲しいギリギリ早期ガンで収まるサイズになります。つまり上限です。
今ほとんどの方が乳腺のしこりが危ないサインであることは知っています。時々自分でチェックしている方も多い。でもサイズを意識していません。検診だから早期で発見できなければ意味がない。だからこれ以上大きくなる前に病院に行かないといけない、それを触感として、手が認識している必要があります。
このビー玉を使って早期発見のために必要なサイズを触感で自覚してもらう。
そしてそのビー玉を、できればそのまま家族で使うお風呂場に置いてもらっています。そうすれば家族みんなの目に止まり、意識をするようになります。お互いに声掛けも行われるし、何より娘がいたなら家族みんなで指導することになります。こうして習慣づけがより容易になります。
試行錯誤するうち、こう指導すれば、自己チェックを始めて、そして継続してもらえる、と確信した現状での到達点です。これはそれを本にまとめたものになります。ビー玉法と呼んでいます。


マンモグラフィ検診をうけておられる女性でも自己チェックはされていなかったりします。そしてその対象年齢ではない娘さんを心配されていたりします。高齢になってマンモグラフィ検診を受けておられない母親を心配されていたりします。そうした娘に、母親に、全ての女性に自己チェックをするよう勧めていただくためにこの本はあります。ぜひ手に取って読んでみてください。そして今日から乳腺の自己チェックを実践してください。
この本は 現在Amazonや、書店では手に入りません。
下記 翔雲社から手に入りますので、良かったらご購入ください。
本紹介:https://www.shounsha.co.jp/list/isbn/isbn978-4-910135-12-0.html
Shop: https://shounsha.stores.jp/items/67a9711dadce6619361be983
定価1,650円(本体1,500円+税)
がんという病気の難しさは、怖さは、完治したかどうか、何年も経過してみないとわからない、いやそれどころか何年たっても完治したかどうかわからない、そのことにあります。
それはがんという疾患の本体は手術をして取り除いた腫瘍、ではなく、じつは ”微小転移”とよばれる、検査をしても現状の検査機器や技術では発見できない見えない転移、にあるからです。そしてどんなに小さく、早期で発見していても、がんである限りはその微小転移が潜んでいる可能性は0ではありません。むしろそれが0ではない腫瘍を”がん”と呼んでいるといっても過言ではないのです(注:ただし乳がんでは非浸潤がん=DCISと呼ばれるものがあります。これは微小転移の可能性が理論上は0です)。
今乳がんに罹患される方は非常に多い。きちんと検診されておられる方も増えました。ですので早期発見で乳がんを見つけて治療をされている方も多い。しかしどんなに早期であってもそれが浸潤がんである限り、微小転移がある可能性が否定できない。だから術後何年にもわたってホルモン剤を飲んでおられるのです。しかし残念ながらその確率が1%だとしても、全体の母数が多くなれば、その1%の方の数も多くなります。
このため、米国における年間の乳がんによる死亡のほとんどは、実はステージ I または II のがんによるものである、という論説が出ていました。
ステージ IやIIの 乳がんの転移再発および死亡の個人リスクは低い (10% 未満) のですが、ステージ I・II と診断される患者さんの絶対数が圧倒的に多いため、この大規模な患者集団が経験する小さなリスクが積み重なって結果的に死亡される方の絶対数は大きくなります。
高リスクのステージ II および III の乳がん患者に対しては、ここ数年に進歩した抗がん剤やホルモン剤などの積極的な補助療法により、これらのがんによる死亡は減少しました。しかしこれを同じようにステージI・IIの低リスクの患者さんにも施行することはとても勧められません。こうした積極的な補助療法がそのほとんどの患者にとっては不必要な過剰治療になるからです。ですので低リスクのステージ I・II の乳がんによる死亡を減らすには、これら早期の低リスクとみられている患者さんの中に、わずかでも含まれている微小転移を有している患者さんを何としても見分ける技術の開発、そしてそれをターゲットにした治療技術の開発が不可避になります。

乳がんによる死亡率は過去 20 年間で 40% 以上減少したことが広く認識されています。これは主に、高リスクのステージ II・III の患者に対する抗がん剤やホルモン治療の術後補助療法の改善によるもので、これによって遠隔再発や転移性乳がんによる死亡のリスクが減少しました。
しかし、これらの改善にもかかわらず、2023 年に米国で浸潤性乳がんで死亡する人は推定 43,700 人です。最近発表された研究において、乳がんによる年間死亡者数のうちステージ I、II、III、IV の疾患による死亡者数の割合と、これらの割合が時間の経過とともに変化したかどうかを調べられました。
2000 年から 2017 年の間に毎年乳がんで死亡した患者のうち、最初に診断されたときにステージ I、II、III、または IV の疾患を呈していた患者の割合はどれくらいか、という調査をしました。乳がんによる死亡が臨床病期によってどれくらい異なっているのかを理解することは、集団レベルの乳がんによる死亡率をさらに低減するための治療戦略を設計する上で重要だからです。
この研究では、監視、疫学、最終結果プログラムのデータを使用し、972,763人の患者を対象としました。2000年から2017年の間に、年間の乳がん診断のうちステージ Iの診断が約49%から54%に統計的に有意に増加したのに対し、ステージ IIおよびステージ IIIのがんの診断は同じ期間に減少していることがわかりました。つまり早期発見される乳がんの比率は増加していました。
全体として、2017年に新たに診断された乳がんの85%はステージIまたはIIの病気でした。5年乳がん特異生存率は95%を超え、ステージ Iのがんでは良好な結果で安定していましたが、この期間中にステージ II、III、およびIVのがんの生存率も統計的に有意に改善しました。これらの観察結果から得られた時間の経過に伴う傾向は、高リスク乳がんに対する補助療法の有効性がどんどん改善していることと一致しています。
今回の研究で最も興味深い発見は、乳がんによる年間死亡率に寄与するステージ I / II のがんの割合が 2000 年から 2017 年にかけて大幅に増加した (ステージ I では 16% から 23%、ステージ II では 31% から 39%) ことです。一方、ステージ III / IV のがんの割合は減少していました (それぞれ 36% から 30%、17% から 7%) 。
つまり以前は乳がんで亡くなる方は進行して見つかった方がほとんどを占めていましたが、乳がんのほとんどが早期発見されるようになった現在、乳がんで亡くなっている方の大部分が、全体数で見たならば実は早期発見された方がほとんどである、ということになっているのです
2017 年には、乳がんで死亡した患者の 62% が、当初ステージ I・II と診断されていました。これらの時間的傾向は、すべてのサブタイプで同様であり、今後数年間も続く可能性があります。
高リスクのステージ II・III エストロゲン受容体陽性(HER2 陰性)乳がんに対しては補助的 CDK4/6 阻害剤(ベージニオ🄬など)の導入がなされました。
ステージ II・III トリプルネガティブ乳がんに対しては化学療法と併用した免疫療法(ペムブロリズマブなど)の導入により、これらの高リスク集団における転移再発率はさらに低下するでしょう。
しかしこれらの薬剤が適応とならない低リスク患者のがんによる死亡は現状のまま変わりません。その結果として、乳がんによる死亡のうちステージ I および低リスクのステージ II がんの占める割合は引き続き増加することになります。
これらの観察結果から、新たな課題、すなわち、一見リスクが低いステージ I および II の乳がんにおける死亡率をいかにして低下させるかという問題が浮上してきています。
単純に高リスクがんに使用される治療戦略をそのまま低リスクの乳がん患者さんにも適用すると、ほとんどの患者で大幅な過剰治療と不必要な毒性が生じることになり、これは現実的に実行可能な戦略ではありません。
補助ホルモン治療の遵守を改善することで、ステージ I・II のエストロゲン受容体陽性乳がんによる死亡率を低下させることができます。これは、低リスクであっても危険性を認識していただき、いままでの治療をより厳密に守るだけですので、今からでも改善可能でしょう。
新しい診断技術(ctDNA モニタリング)が期待されています。
ctDNA(circulating tumor DNA) とは、がん細胞が死滅する際に血液中に放出されるDNA断片のことを指します。近年、このctDNAを血液検査(リキッドバイオプシー)で解析することで、がんの診断・モニタリング・治療効果の評価・再発リスクの予測などに活用する技術が注目されています。
早期診断:一部のがんでは、ctDNAを検出することで早期発見が可能とされています。例えば、肺がんや大腸がんなどで研究が進んでいます。
治療効果の評価:治療前後のctDNA量の変化 を測定することで、治療が効果を発揮しているか判断できます。例えば、化学療法・免疫療法・分子標的治療の効果をモニタリング可能です。
低残存病変(MRD:Minimal Residual Disease)の検出:手術や治療後にctDNAが残っていると、がんの再発リスクが高い と考えられます。早期にctDNAを検出し、再発リスクを予測することで、追加治療を検討できます。
再発・転移の早期発見:血液中のctDNAを定期的に測定することで、がんが再発または転移した兆候を早期に発見可能です。従来の画像診断(CTやMRI)よりも早期に検出できる可能性があります。
遺伝子変異に基づく治療選択:ctDNAを解析することで、がん細胞のドライバー遺伝子変異(がんを成長させる変異)を特定できます。これにより、個別化医療(プレシジョン・メディシン) を実施できます。EGFR変異(肺がん)やKRAS変異(大腸がん)などを特定し、適切な分子標的薬を選択できます。
今回の話題では、ctDNAに関する3・4の技術の応用によって、一見早期がんに思われる乳がんの微小転移を見つけることができないか、と開発が進んでいる、と述べているわけです。
これによって、早期乳がんであったがじつは再発寸前である、あるいは微小転移性疾患がある、こうした患者を特定できるという希望を与えてくれます。
その場合、早期介入によって転移再発を回避できる可能性があります。しかし、転移再発の予測因子としての血漿 ctDNA の上昇の分析的妥当性および予後妥当性は広く受け入れられていますが、追跡中の ctDNA 陽性に基づく早期介入によって生存率を改善できるかどうかは不明のままです。つまりctDNAは有効だが、それを踏まえてどう対応すればいいかがわかっていない、ということになります。
ctDNA検査は現在まだまだ高額ですが、現在進行中および将来の臨床試験で、こうした早期介入により再発率が低下することが証明されれば、転移性乳がん治療の高額かつ継続的なコスト増加を考慮すると、低リスクのステージ I および II 乳がんの ctDNA モニタリングは費用対効果が高くなる可能性があります。そうなれば一般的に施行できるレベルになる可能性が出てくることでしょう。
2025.02.04
ここ最近も脳転移について記事を書きました。
乳がんが転移し、ステージIVとなった時、その方の生命予後を決定しているのが脳転移の進展による、そういう状況が次第に増えています。抗がん剤やホルモン剤の進歩によって脳転移以外の転移巣はなんとかコントロールできているのに、脳転移だけはコントロールできず進展する、そして生命を脅かす、乳がんの脳転移のコントロールは大きな課題になっているのです。
特にHER2陽性乳がんは、抗HER2療法と呼ばれる薬剤が近年素晴らしい進歩を遂げました。ハーセプチン🄬の開発をきっかけにパージェタ🄬や、エンハーツ🄬など、素晴らしい薬剤が次々登場し、たとえ遠隔転移があるステージIVとして見つかっても、治癒する可能性が十分ある、そんな時代になっています。そしてだからこそ逆に、こうした分子標的薬剤の効きにくい部位である中枢神経系への転移が残された課題として問題になってきているのです。
そして脳病変を伴う転移性 HER2 陽性乳がんの生存率は、その病変の位置によって異なることが、大規模なデータの解析で示されています。前回も述べた播種性転移と血行性転移の違いです。
診断時に髄膜播種を患っていた患者の全生存期間(OS)の中央値は1.24年であったのに対し、実質または硬膜病変を患っていた患者(血行性転移での脳転移と考えてください)では3.57年でした。
中枢神経系に限定された転移性乳がんの患者さんでは、やはり中枢神経系関連での死亡のリスクが高く、3年後の死亡率は33.98%であったのに対し、他の原因による死亡率は6.07%でした。
ニューヨーク市のメモリアル・スローン・ケタリングがんセンター(MSKCC)のネルソン・モス医師と共著者らは、274人の患者集団全体の死亡の半数以上が中枢神経系関連の原因によるものだとJAMAネットワークオープンで報告しました。
「中枢神経系の進行が最も一般的な死亡原因であった」と結論付けています。
「中枢神経系のみに転移を有する患者さんは、頭蓋外に転移を同時に起こした患者さんよりも生存期間が長かったが、中枢神経系にしっかり局所療法をされている患者さんの割合が高いにもかかわらず、それでも中枢神経系関連での死亡率は高かった」と研究者らは述べました。
「より効果的な中枢神経系にきちんと浸透して効果を発揮する全身療法が緊急に必要とされています。」
脳や延髄、脊髄などの中枢神経系はたいへん重要な部位になります。そのため、血液の中に入り込んだウィルス、細菌、そして寄生虫などが脳や脊髄に入り込まないように、Blood-Brain-Bareer(通称BBB)と呼ばれる特殊な構造があり、血液中の比較的大きな分子が染み出してこれないように守られています。酸素や栄養だけ送れ、それ以外は決して通さない!という門番がしっかりいるのです。
ただ近年開発され、がん治療で大成功を収めた分子標的薬剤と呼ばれるハーセプチン🄬やパージェタ🄬などは、比較的分子量が大きく抗がん剤の中でも大きな物質になります。このためBBBを突破できず、脳や脊髄への移行が期待できないため、脳転移巣に限って”効きが悪い”ことになるのです。そしてそれが今非常に問題になっているのです。
BBBを突破して、浸透し、ハーセプチンやパージェタ同様にしっかりとがんに効く薬の開発が緊急かつ重要な課題となっています
「新しい抗HER2やその他の抗がん剤が登場するにつれ、臨床試験では薬剤開発の初期段階から頭蓋内効果を評価するためにCNS疾患の患者も対象にすべきです」と研究者らはのべました。「さらに、試験設計にはCNS関連死亡率など、CNSの結果に特に対処したエンドポイントを組み込むべきです。」
「今回の結果は、HER2陽性転移性乳がんにおける中枢神経系への影響の大きさの評価に根本的な変化をもたらします。今回の研究により、中枢神経系に転移した乳がんは、もはやどうしようもないあきらめにいたる前兆などではなく、治療の可能性に満ちたダイナミックな状況、つまりチャンスの場として再定義するべきだと考えます」と、ミラノ大学のダリオ・トラパニ医学博士と共著者らは主張しました。「中枢神経系に転移をきたしたHER2陽性乳がんの治療における変革への道筋を示しました。分析から得られたことは、脳転移はもはやどうにもならない終着駅だ、という考え方を否定し、中枢神経系への治療の挑戦こそが変革的な結果をもたらす最前線であるという議論を提示していると思います。」
進行性HER2陽性乳がん患者の約3分の1に脳転移は起こります。転移性HER2陽性乳がんの生存率は、より新しく効果的な治療法の登場により過去10年間で大きく改善しましたが、これら多くの薬剤の有効性は中枢神経系ではなく頭蓋外の転移巣への効果によってもたらされています。
中枢神経への転移はこれからの治療上の重要な課題となっています。手術や放射線治療などの脳への局所療法は局所の病気のコントロールと症状の緩和に有効ですが、潜在的な副作用のリスクも伴っており、いまだに全生存率と 中枢神経系転移関連死亡率への影響は不明なままになっています。これらの患者の死亡原因に関するデータをきちんと回収し、中枢神経系転移関連死亡とその潜在的な相関関係をより深く理解することで、積極的な局所療法の選択に役立つ可能性があります。
この研究では、研究者らは、2010年8月から2022年4月までに施設で治療を受けた転移性HER2陽性乳がんおよび中枢神経系転移疾患のすべての患者の記録を解析しました。主要評価項目は全生存率と中枢神経系転移関連死亡率でした。
こうして追跡した患者さん274 人の平均年齢は 53.7 歳でした。中枢神経系転移の診断時に、患者の 26.6% が 中枢神経系転移のみ患っていました。生存患者におけるコホートの平均追跡期間は、中枢神経系転移の診断から 3.7 年でした。
全死亡率と中枢神経系転移関連死亡は、診断時の中枢神経系転移のパターンと有意な相関関係がありました。全死亡率は播種性転移患者で最も悪く、頭蓋外にも転移を有している患者さんでは中程度 (2.16 年)、そして実質または硬膜病変のみの患者(血行性転移のみ)の患者さんでは最も良好でした。
追跡期間中に死亡した 192 人の患者さんのうち、55.2% が中枢神経系転移関連の原因で死亡しました。中枢神経系転移関連死亡の統計では、播種性転移の有無と全脳放射線療法の有無が 中枢神経系転移関連死亡の独立した予測因子であることが示されました (それぞれ HR 1.87、95% CI 1.19-2.93、P =0.007、および HR 1.71、95% CI 1.13-2.58、P =0.01)。
2025.02.03
皆さんはGLP-1という一種のホルモンを利用したお薬を知っていますか? これやせ薬です。
GLP-1(グルカゴン様ペプチド-1)は、腸管ホルモン(インクレチン)の一種で、食事の後に小腸から分泌され、血糖値の調節に重要な役割を果たします。以下のような働きがあります:
インスリン分泌の促進:血糖値が上昇すると、膵臓のβ細胞からインスリンの分泌を促進します。これにより血糖値を下げる効果があります。
グルカゴン分泌の抑制:膵臓のα細胞から分泌されるグルカゴン(血糖値を上げるホルモン)の分泌を抑えます。
胃の排出遅延:胃の内容物の排出を遅らせることで、食後の血糖値上昇を緩やかにします。
食欲抑制:中枢神経系に作用して食欲を抑える効果もあります。
GLP-1受容体作動薬(GLP-1アゴニスト)と呼ばれるGLP-1の作用を利用した糖尿病治療薬や肥満治療薬が開発されています。これらの薬は、GLP-1の働きを模倣または強化することで血糖値をコントロールし、体重減少にも効果を発揮します。有名な薬剤には以下があります:リラグルチド(ビクトーザ、サクセンダ) セマグルチド(オゼンピック、ウゴービ)これらは特に2型糖尿病(インシュリン使用にまで至らない糖尿病)や肥満治療に使われることが多いです。
私のブログを読んでいる方、私の患者さんではもう耳にタコができるか、きくのも嫌になっていると思いますが、乳がんに罹患された後、もし再発を防ぐために”皆さんが”できることで、確かに効果ありと証明されていることは一つしかありません。(ホルモン剤をきちんと飲むとか、抗がん剤をするなど、医者がすることを別にして)
それは規則正しい運動を心がけて、太らないこと、です。
しかし乳がんのような大きな病気を経験されると、それをきっかけに今まで通っていたジムをやめてしまったり、趣味の山登りやマラソンをやめてしまったり・・・なにより年齢は嫌がおうでも拾いますから、じわじわと太ってしまわれている方は多いのが現状です。
先生、ホルモン剤のせいじゃないですか?
「ホルモン剤は0カロリーです。食べなければ太りません。」
なんて会話を私としたことのある患者さんは多いですよね(笑)。
なんか、痩せる薬とかないですかね? とそうなりますよね。
あることはあるんです。それがGLP-1です。
もちろんその目的で保険が通ることは考えにくいですから、わが国ではほとんど普及していません。ただ米国では現状積極的に使われているようです。そしてそれを実際に臨床で使用されている、そして全国で講演までされている先生のコラムがありましたので紹介したいと思います。示唆に富む、そして非常に興味深い話になっています。

GLP-1をベースとした肥満治療薬であるセマグルチド(オゼンピック、ウィーゴビー)とチルゼパチド(ゼップバウンド)ほど急速に人気が高まった薬はほとんどありません。これらの薬によって肥満治療薬は大きな進歩をしましたが、そう考えられる十分な理由があります。セマグルチドが2021年にFDA(米国における厚労省、保険適応を決めている)に承認されるまで慢性的な体重管理に最も効果的な薬は、おそらく1959年に初めて承認されたフェンテルミン(アディペックス)だけでした。60 年以上も効果が疑問視され、進歩が止まったままであった中で、患者や医師が 新しく登場したGLP-1 を待望の画期的成果とみなしたのは驚くことではありません。
私も最近まで、そのような医師の一人でした。
肥満医学の専門医として、私は早くから声高にこの画期的な薬の使用を主張してきました。GLP-1 療法の臨床試験に参加し、肥満に対する前例のない有効性について公に頻繁に講演しました。私はこれらの薬に対する期待を皆さんとともに共有し、高額な費用、限られた保険適用、早期に終了したクーポン プログラム、供給不足など、皆さんもご存じのさまざまな障壁にもかかわらず、患者とともにこの薬を保険適応とし、安価に入手するために戦いました。
しかし、数年経って、現実世界での経験に基づいて私の見方は変わり、今では GLP-1 薬の使用について深い懸念を抱いています。
ただし誤解しないでください。効能の観点から言えば、これらの薬は「効きます」。GLP-1 を服用できる余裕があり、我慢でき、継続できる人は、確実に体重を減らします。私は、空腹感を減らし、食べ物の音を静め、満腹感を高めることで、体重を減らす能力がどのように変化するかを直接見てきました。そして、そのメリットは体重減少だけにとどまりません。研究では、心血管イベントの減少が確認されています。うっ血性心不全などの症状の改善、腎臓病、閉塞性睡眠時無呼吸、および変形性関節症が改善することも明らかになっています。
これらの薬が意図されたとおりに、つまり無期限に服用される限り、その効能は否定できません。しかし、これらの薬の服用を中止すると、身体と精神に何が起こるのでしょうか。ここに問題があります。
実のところ、ほとんどの患者は抗肥満薬を服用し続けません。私は毎日診療でそれを目にしています。研究によると、患者の4分の3は2年以内にGLP-1薬の服用を中止しています。多くは数か月以内に中止しています。中止の理由には、費用、副作用、供給不足などがあります。しかし、最も一般的な理由の 1 つは、患者が単に減量薬を無期限に服用したくないということです。多くの人は、「システムを打ち負かす」ことができると信じており、短期間服用し、ライフスタイルを変え、体重が戻らずに服用をやめることができる、と信じて服用をやめてしまうのです。
しかし残念ながら、それは不可能です。セマグルチドとチルゼパチドの臨床試験では、平均的な患者は3分の2のリバウンドが見られました。減量した体重の約半分(および心臓代謝変数の同様の変化)は、中止後 1 年以内に元に戻ります。人によっては、体重がほぼ瞬時に元に戻ったように感じ、最初に減った体重よりもむしろ超えて戻ってしまうことがよくあります。私の患者は、食べ物の誘惑が再び現れて、空腹感と敗北感を覚えると言います。
GLP-1薬の科学的な作用のしくみは、これらの薬が永久的な変化を引き起こさない理由を説明しています。これらの薬は、グルカゴン様ペプチド-1受容体の外因性合成アゴニストです。使用中、これらの薬は特に脳と胃の受容体を飽和させ、非常に高い持続レベルで内因性GLP-1の効果を模倣します。しかし薬の使用を中止すると、その効果は2~4週間以内に消えます。受容体はもはや空腹を鎮めるペプチドで満たされておらず、空腹感が猛烈に戻ってくる。そして体重もすぐに増える。
その結果、多くの患者が治療と中止を繰り返し、最終的に失うのは年間12,000ドル以上のお金だけになります。(ほとんどの場合、米国でも保険が使えません)
この悪循環は、我が国の身体的、精神的、経済的健康、そして肥満に苦しむ何百万もの人々にとって、長期的には重大な影響を及ぼす可能性があります。何百万もの人々に GLP-1 の短期使用を強いると、社会に何が起こるのでしょうか。結局、痩せることに失敗し、たくさんお金を使ったことだけが残る。私たちは結局、医学の最も基本的なルールである「害を与えない」に違反しているのでしょうか。
これらの薬をやめることによる悪影響は体重の増加だけにとどまらず、体重の増減には一定のリスクが伴うこともまたわかっています。体組成を測ると、GLP-1による治療中、患者は筋肉量を失うことがわかっています。脂肪とともに、筋肉の損失の多くは回復しないという研究結果が出ています。中止してその後体重が元に戻った場合、戻った体重は主に脂肪であり、筋肉ではありません。これにより、筋肉量が減り、基礎代謝率が低下し、将来の減量が困難になるなど、むしろ治療前より状態が悪化する可能性があります。健康への影響としては、筋力の低下、骨密度の低下、骨折リスクの上昇などがあります。
心理的には、体重が元に戻ると肥満に関する誤解や偏見が強まります。患者はまたしても「失敗した」試みに対して自責の念と恥を感じ、それがうつ病や自信の低下につながることも少なくありません。
最後に、何百万人もの人々がこれらの薬を服用したり中止したりすることで生じる経済的損失は計り知れません。人々はこれらの薬に毎年何千ドルも費やして大きな犠牲を払っているが、結局は体重が元に戻ってしまう。医療経済はこれ以上膨れ上がる費用に耐えられない。全国の州ではすでに、維持不可能な費用を理由に保険の適用を停止している企業もあります。
患者が何万ドルも費やし、不快で時には深刻な副作用に耐えた後、私たちはこの時代を振り返ることになるのではないかと私は恐れています。そして体重増加の繰り返しと食事に関する不満の復活を経験した後、こう自問するのです。
「これらの薬が「効く」としても、本当に効いたのだろうか?それとも、最終的に患者、社会、経済に害を及ぼしたのだろうか?」
まとめ
たとえは悪いですが、まるで覚せい剤ですね。
疲れが取れない、何も手につかない、でも覚せい剤を使うと超人になったように眠ることなく、どんどん仕事がはかどる。なんでもできるような気がする。
でも薬が切れた途端に、前にもまして恐ろしい疲労感と、無力感にさいなまれる。仕方なく、また覚せい剤を使う。もはやお金をいくら使ったかもわからないが、もうやめられない。
やはり楽して、というか薬でなにかを得ようとしても、必ず何かを同時に失う、ということですよね。生活習慣に伴う病気は生活習慣を先ずは正す。それ以外の解決方法はそれがまずできてから、そう思います。
2025.01.31
最近、転移を有しているステージIVの乳がん患者さんから、もし乳がんが再発したら、症状がなくても定期的に脳転移のスクリーニング検査をするべきかどうか、相談がありました。それについてタイムリーな記事が米国でありましたので、紹介してみたいと思います。
ただ最初に述べておきますが、現状では”症状がなければ定期的な検査はしない”ことがガイドライン上は正しいとされます。不安だから、興味があるから、調べておきたいから、という理由だけでは脳の検査に限らず検査は行われないのが普通です。それにより延命や、QOLの改善などメリットが得られなければ、検査は行われません。脳転移の定期的なスクリーニング検査にはメリットが証明されていないのです。
乳がんは全身のどこにでも転移をしますが、特によく転移を起こすのが骨です。肝臓、肺にも転移をします。骨転移、特に背骨や腰椎など、脊椎に転移をきたすと、骨髄にがん細胞が常に供給されるようになります。髄液中に浸潤し、がん細胞がその液体に乗って、”播種性”に脊髄、脳に転移をします。脊髄液にがんの種を混ぜて撒いているような感じです。ですので、播種と言ってばらばらと小さく広く転移をきたします。それ以外に血流から脳転移をきたすこともありますが、そういった場合には小さな結節で脳の実質の中に転移巣を形成します。
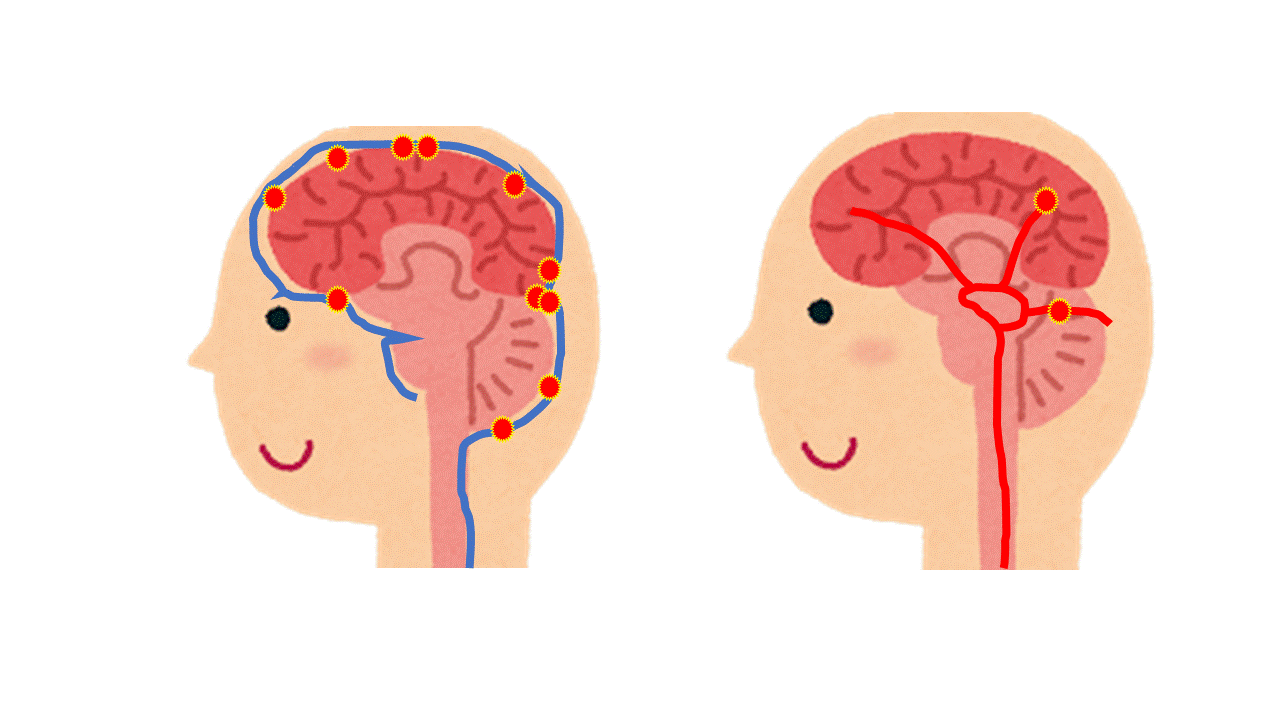
播種性転移:髄液は脊髄から脳の周辺を循環しており、これに乗って骨の転移巣からがん細胞が運ばれると、種をまくように小さな腫瘤が表面にばらばらと形成される形態をとって転移する
血行性転移:血流にのってがん細胞が運ばれてきて、脳に転移巣を形成すると、脳の実質の中に孤立性に腫瘤を形成する形態をとる。
ただ多くの場合、この両者は混在している。
脳は体のパーツの中でも特別大切な臓器なので、転移があるからと言って全部切除する、という治療方法はとれません。部分的に切り取ることも非常に難しい臓器です。
もし乳がんの脳転移が、孤立性に腫瘤を形成する後者の形態で発生したなら、極端に言えばそこを手術で切除する、ガンマナイフや重粒子線を使って焼く、という治療方法が取れる可能性があります。
しかし前者のように小さいながらもばらばらと脳や脊髄の表面全体に広く”播種”してしまうと、そこだけを治療することはできません。
そこで全脳照射という方法をとることになります。脳全体を放射線治療で焼くという方法であり、やはりそれなりの大きな副作用を覚悟しなければいけなくなります。
そのことを踏まえた上で下記の考え方が出てきます。
定期的に脳転移をチェックしておき、播種をきたす前に、孤立性の転移で済んでいるうちに転移を発見できれば、全脳照射を避けることができ、そこだけを焼くような治療ができるのではないか。大きな副作用を覚悟せずとも延命できるのではないか。
現代の乳がん治療では免疫療法、抗がん剤治療、ホルモン治療の進歩によって、がんの進行を抑制し、全身に転移をきたした状態でも何年も延命できるようになりました。がんを完全に根絶できなくても、共存しながら何年も粘っていけるようになっています。しかし様々な理由があって薬物治療は脳転移には効きにくいのです。ですので、近年、せっかく肝臓や骨の転移は薬で抑え込めているのに、脳転移だけがじわじわ進展してきている、という患者さんが大変多くなってきているのです。
乳がん治療において、脳転移のコントロールは、現代医療においても最後に立ちふさがっている大きな壁なのです。

定期的に脳転移のチェックをする。それはCTやMRIの力を借りなければなりませんが、決して不可能ではありません。ただ、現在の米国立総合がんネットワーク(NCCN)のガイドラインにおいて「乳がん患者の脳MRI検査は、症状がある場合にのみ行うべきである」と明記されています。
それは、かならずしも血行性の転移(後者)が先に起こり、それから播種性の転移(前者)が順番通り怒るとは限らないからです。前述しましたが、乳がんはよく骨転移します。そこから髄液にがん細胞が落ち、播種するのであればむしろ播種が先に起こることも珍しくはありません。ですので、定期的に脳のチェックをして、播種する前に孤立性の転移で見つける、ということは難しいと考えられているのです。
ただ最近になって、フロリダ州タンパのモフィットがんセンターのカムラン・アーメド医師らは、そうとも言えないのではないか、という論文をNeuro-Oncology誌に発表しました。
彼らは、症状のない乳がん脳転移に関する前向きのデータを収集するため、ステージ IV 乳がん患者を対象に単群非ランダム化第 II 相試験(数を集めて観察する)を実施しました。
HR 陽性/HER2 陰性乳がん患者は、転移性疾患に対する治療を少なくとも 1 回受けている人が選ばれました。トリプルネガティブ乳がん(TNBC) または HER2 陽性乳がんの患者さんは、以前の治療回数に関係なく今回の観察に参加しました。脳転移の症状がすでにある患者は除外されました。
研究対象患者 101 名の内訳は、HR 陽性/HER2 陰性乳がん患者 40 名、HER2 陽性疾患患者 33 名、TNBC 患者 28 名でした。うけた治療回数の中央値は、それぞれ 4 回、2 回、2 回でした。
観察開始時、つまり全く脳転移の症状がなかった最初の段階で施行した MRI スキャンにおいて、患者さんの 14% に脳病変がすでに検出され、TNBC 患者では 18%、HER2 陽性患者では 15%、HR 陽性/HER2 陰性患者では 10% でした。
その後 6 か月後のフォローアップ MRI の対象となる 87 人の患者のうち、66 人がフォローアップ評価に参加しました。フォローアップ MRI の完了後、脳転移の累積発生率は、TNBC で 25%、HER2 陽性で 24%、HR 陽性/HER2 陰性疾患で 23% でした。
最初の MRI スキャンが陰性であった 乳がん患者さんのうち、10 人の患者さんが、スキャン間の 6 か月の間隔中に脳転移を発症しました。
転移を有する乳がん患者さんではその4分の1が、MRIによる観察研究に参加してから6か月以内に無症状の脳転移が検出されました。観察開始の脳MRIの結果においても、101人の患者のうち14%にすでに無症候性の脳病変があり、トリプルネガティブ(TNBC)およびHER2陽性の腫瘍を持つ患者では、ホルモン受容体(HR)陽性/HER2陰性の腫瘍を持つ患者よりもその割合が高いという結果でした。6か月後の追跡MRI評価後、総発生率は24%に増加し、それは乳がんのサブタイプ間で同様であり、これまで認識されていたよりも高いものでした。
MRI で脳転移が検出された患者のうち、16 人 (67%) が局所定位放射線治療 (SRS) を受け、1 人が術前 SRS 後に外科的切除を受け、3 人が海馬回避型全脳照射( WBRT) を受け、2 人が従来の WBRT を受けました。9 人 (38%) の患者は脳転移の診断後に全身療法が変更になりました。
この結果をWBRTにならずに済んだ方が多い、とみるか、結局WBRTが必要になる方では必要になる、とみるかは、今後、定期的に脳転移をチェックした群と、しなかった群を比較しないと結論は出せない、と言えます。ただ今回の試験に参加しなかったらこれらの患者さんは皆さん脳転移が発見されるのは症状が出現するまであり得ないので、もっと遅くなったはずです。そうなればWBRTの必要になった方はもっと多くなった可能性もあるといえます。
カムラン・アーメド医師らは、MRI検査を定期的に行わなければ、症状が出て初めて脳転移が発見されます。しかし乳がん患者が脳転移の症状を呈したときには、その病状がより進行している傾向があることは間違いありません。そうした患者さんでは全脳放射線療法(WBRT)を必要とすることが多くなります。
今回の研究結果は、症状のある脳病変にのみMRI検査を支持する現在の臨床ガイドラインの再検討が必要なのではないか、ということを示唆していると、カムラン・アーメド医師らは報告しています。
まとめ
乳がんが肺、肝臓、骨などに転移再発した際、たとえ症状がなくてもすでに10%以上の方で脳転移も同時に伴っている可能性があります。それはさらに6か月経過することで20%以上に増加します。定期的に脳の検査をすれば、症状がないうちからその転移を発見することができ、全脳照射を避けることができる可能性があります。
しかし、定期的に脳の検査をすることで全脳照射を避けることができたとしても、現段階ではそのことが最終的な延命につながるという結果は出ておらず、QOLを改善できることも証明されていません。
現状、乳がんの転移があれば定期的な脳の検査をするべきである、という結論までには至っていません。
ご予約専用ダイヤル
079-283-6103