2025.05.09
パクリタキセル、ドセタキセル、などタキサン系の抗がん剤を投与された方に、末梢神経障害、たとえば手足の指先がしびれて違和感があったり、感覚の鈍麻があったり、ひどい時にはピリピリ痛んだりする症状が出現し、治療が終了した後も長く残ることがあることが知られています。
この副作用はタキサンが登場したときから問題になっており、様々なお薬が試されてきましたが、いったん症状が出てから治療をしようとしてもなかなかうまくいかないことが多かったのも事実です。
これを予防する方法がある程度確立しつつあるようです。
つまり副作用の症状が出てから治療するのではなく、症状が出ないようにタキサンを投与しているときから工夫する、その方法が確立しつつあるということになります。
JAMA Oncologyに報告されたドイツの単一施設試験 (POLAR) において、Michel 先生らは、タキサン投与中の患者さんの手を冷却し、同時に圧迫することで、原発性乳がんの女性におけるタキサン誘発性神経障害のリスクを低下させることができることを発見しました。
簡単に言えば、薬を投与しているときに、手の血流を低下させて、薬が流れる必要のない指先(めったに転移を起こすことがない部位だから)に薬が届かないようにすれば、そもそもしびれは発生しにくい、という考え方です。
具体的には、手の冷却は凍結手袋(ケーキなどについてくるアイスノン®によく似た素材で作られた手袋を冷やしておく)で実施されました。手の圧迫は2枚の手術用ゴム手袋(ぴったりフィットするサイズより1つ小さいサイズ)を着用することで実施されました。これらをタキサン投与の30分前、投与後、および投与中に施行します。
この試験では、2019年11月から2022年1月の間にハイデルベルク国立腫瘍センターに登録された101人の患者が、利き手に対して冷却(n = 52)、または圧迫(n = 49)を受けるように無作為に割り付けられ、非利き手は治療されませんでした。
毎週、ナブパクリタキセルベースまたはパクリタキセルベースの術前または術後化学療法を受けていた患者が登録されました。
以前に化学療法を受けていたことのある患者さん、または既存の神経障害/神経障害関連の合併症があった患者さんは解析から除外されています。
主要評価項目は、グレード2以上の重症である化学療法誘発性末梢神経障害(CIPN)の予防ができるのか、でした。
結果ですが、手を冷却する、圧迫する、そのどちらにおいても、グレード2以上のCIPNの発生率が有意に減少しました。
手冷却群では、治療群でグレード2以上のCIPNが認められた患者は15名(29%)であったのに対し、対照群では26名(50%)でした(P = .022、効果サイズ = 21.15%、95%信頼区間[CI] = 5.98%~35.55%)。
手圧迫群では、治療群でグレード2以上のCIPNが認められた患者は12名(24%)であったのに対し、対照群では19名(38%)でした(P = .008、効果サイズ = 14.29%、95%信頼区間[CI] = 2.02%~27.24%)。
たとえばゴム手袋をするだけで予防ができるなら、非常に簡単です。
冷却もそんなに難しくありません。指先フローズングローブで調べていただければ安価でう販売されているものが見つかります。ゴム手袋をした上からして、圧迫したうえで冷却することでさらに効果が上がる可能性もありそうです。
簡単にできることなので、ぜひ実施していただきたい、と思います。
この論文は今年の3月に発表されています。私が存知している限りでも、わが国でタキサン系薬剤を投与している施設の多くが、すでにこの工夫を採用し、実施が始まっているようです。皆さんが心配する必要はなく、もしその話が出なかったら、でいいと思います。
実際にうけた患者さんもおられるのですが、この処置は結構つらいと聞いています。氷をじっと触っているのはつらいですものね。圧迫か、冷却か、両方するか、医師と相談して施行する必要がありそうです。
まとめ
タキサン系薬剤を投与する際に、指先を圧迫し、冷やしておくことで、血流を抑えることができ、そのことで末梢神経障害を予防することができます。
ただしきちんと管理した状況で施行しないと凍傷の心配があります。またタキサン系抗がん剤を投与しているときに施行しないと意味はないので注意は必要です。
2025.04.25
米国臨床腫瘍学会(以下ASCO)は、早期乳がんにおけるセンチネルリンパ節生検(以下SLNB)の役割に関する臨床実践ガイドラインの最新版を発表しました。
この最新版の作成には、2017年に最後に発表されたガイドライン以降に発表された試験の結果に基づく推奨事項が含まれており、SLNB単独と腋窩リンパ節郭清を伴うSLNBを比較した9件のランダム化試験と、SLNBと腋窩リンパ節郭清なしを比較した2件の試験のデータが含まれています。
「数十年前には、乳がんの治療に際しては、がんが腋窩のリンパ節に転移しているかどうか知る必要があると考えていました。そのためには、少なくとも10個以上のリンパ節を切除して、検査する積極的な手術が必要だと考えていました」と、エモリー大学ウィンシップがん研究所のガイドライン共同議長であるマイリン・A・トーレス医師は説明しました。
「しかし、リンパ浮腫、腕の痛み、肩の可動域制限といった症状が高率に発生し、多くの女性の生活の質に影響を与えていることにすぐに気づきました。リンパ節転移が陰性であったとしても、時には理由もなくそのような症状が現れることもありました。
そうした合併症を防ぐために、広範囲にわたる 腋窩リンパ節の郭清を行う機会は徐々に減少し、臨床的にリンパ節陰性と考えられる早期乳がんの患者さんにおいては SLNBによって数個のリンパ節を検査するだけでいい、という考え方に進化しました。
腋窩への手術を縮小することで、上肢のリンパ浮腫の発生率が低下し、全体的な生活の質が向上しました。そして治癒率や再発率には悪影響や低下は見られませんでした。
そしてその後には今度は、浸潤性乳がんの患者は全員、リンパ節転移を正確に評価するために腋窩のリンパ節をすべて取るようなことはしない代わりに、センチネルリンパ節生検(SLNB)を受ける必要があると考えられてきました。この情報は、適切な術後治療を決定する上で非常に重要でした。」
今回更新された臨床における実践ガイドラインでは、
閉経後、50歳以上、術前の腋窩超音波検査でグレード1~2、腫瘍サイズが2cm以下、ホルモン受容体陽性、HER2陰性、これらを満たす乳がんと診断され、乳房温存療法を受ける特定の患者に対して、術者はSLNBを省略することが推奨されています。
この推奨は、SOUND および INSEMA という 2 つの臨床試験の結果に基づいています。
第III相 SOUND 試験では、術前の腋窩超音波検査で陰性の所見が得られた早期乳がん患者において、腋窩手術を省略してしまっても、 SLNBを施行することに対して非劣性であるかどうかを比較しました。5 年遠隔無病生存率は 2 つのグループで同程度でした。
第III相 INSEMA 試験では、乳房温存手術を受ける予定の臨床的にリンパ節陰性の ≤ 5 cm 浸潤性乳がん患者において、腋窩手術の省略が SLNB に対して非劣性であるかどうかを評価しました。生存率の評価において腋窩手術の省略が SLNB に対して非劣性であることが示されました。
「SLNBの省略は乳がんの局所治療分野(手術や放射線治療)における大きな変化であり、他の多くの大きな変化と同様に、これらの知見を実践するにはある程度の意図的な努力が必要になると予想しています」と、ブリガム・アンド・ウィメンズ病院、ダナ・ファーバーがん研究所のKo Un Park医師(ガイドライン共同議長)は述べています。
「なぜなら、SLNBの情報がなくなってしまえば、それに基づいて構築されてきた放射線腫瘍医と腫瘍内科医が、その後の放射線治療および全身療法の計画を行う上で、何を基準に決定すればいいか、現状ではわからなくなってしまう可能性があるからです。」
ただ今回の改正では、SLNBが省略されても、臨床医は今まで通りに放射線療法を施行し、腋窩のリンパ節転移がないとしても必要である全身療法があるならば、それを推奨することを変更すべきではないと述べています。
このガイドラインを定めた専門家チームは、この改正に、SLNBの省略が放射線療法や全身療法の決定にどのような影響を与えるかについての追加情報を含めました。この情報は、多職種チームが手術前に微妙な状況を検討できるようにするために作成されました。パーク医師によると、SLNB 省略のもう一つの難しい点は、SOUND と INSEMA の初期検査に腋窩超音波検査が含まれていたことです。これは普遍的な方法ではありません。これはまた、実務上の課題も提起しています。診察では脇の下に何も疑わしい兆候が見られなかったのに、超音波検査で何かが見つかった場合どうすればいいか、実はまだわかっていないのです。転移ありとしてしまっていいか、まだ決まっていません。超音波検査でリンパ節転移が検出された場合はどうすればよいのでしょうか?臨床試験データはまだありません。
改訂版におけるその他の重要な推奨事項には、診断時に臨床的にリンパ節陰性であり、5cm以下の浸潤性乳がん患者さんが、乳房切除術を受け、センチネルリンパ節が1~2個陽性であっても、乳房切除後に局所リンパ節照射を受けていれば、追加で腋窩リンパ節郭清をする必要はない、とします。
この推奨事項は、腋窩リンパ節郭清を受けた患者の5年生存率に改善が見られなかったSENOMAC試験のデータによって裏付けられています。
トーレス医師とパーク医師はともに、SLNB と 腋窩リンパ節郭清の施行または省略に関する推奨事項は今後数年間にわたって進化し、変化を続ける可能性が高いことを認めました。「今後、より多くの研究で、SLNBを省略できる患者層がさらに広がると予想しています。画像診断技術が向上すれば、リンパ節ががんに侵されているかどうかをより確実に判断できるようになり、SLNBを行う必要性は減っていくと考えています。」
まとめ
・閉経後、50歳以上、術前の腋窩超音波検査でグレード1~2、腫瘍サイズが2cm以下、ホルモン受容体陽性、HER2陰性、これらを満たす乳がんと診断され、乳房温存療法を受ける特定の患者に対しては、術者はSLNBを省略する、つまり腋窩には何も手を加える必要はないことが推奨されています
・診断時に臨床的にリンパ節陰性であり、5cm以下の浸潤性乳がん患者さんが、乳房切除術を受け、最終的にセンチネルリンパ節が1~2個陽性であっても、乳房切除後に局所リンパ節照射を受けていれば、追加で腋窩リンパ節郭清をする必要はない、ことも同時に推奨されました。
2025.04.22
乳がんにはさまざまなサブタイプが存在しており、特にホルモン受容体陽性と陰性、HER2タンパク陽性と陰性は非常に大きな分類の基準になります。それぞれ2×2になるので4タイプ、ホルモン受容体陽性HER2タンパク陰性がルミナールA、同じく陽性陽性でルミナールB、陰性陽性でHER2-enrich、陰性陰性でトリプルネガティブタイプと分類されます。
この4タイプは治療における考え方が全く違ってしまうので、非常に大きな影響があります。
ただ陽性陰性が白黒はっきりしていればいいのですが、こうした場合の常で灰色の時があります。
HER2タンパクについては0、1+、2+(Fish-)、2+(Fish+)、3+と別れており、2+(Fish+)が陽性として扱われ、HER2に対する治療薬が選択されてきましたが、エンハーツの登場でその様相が全く変わってしまいました。低発現である1+、特に2+(Fish-)に関しては、抗HER2療法が効果があることが明らかになっており、すでにその知見を活かした治療は始まっています。
ホルモン受容体に関してはHER2タンパクと違う基準が設けられており、がん細胞の中の受容体陽性の細胞の比率と、その強度であらわされる基準が多く採用されています。90%++とか5~10%+という風にあらわされます。
ただ我が国ではプロゲステロンレセプターだけが陽性などの症例はともかく、エストロゲンレセプターに関しては1%でも陽性であれば原則ホルモン剤が投与されているので、あまり”低発現”という概念がありませんでした。低だろうが、高だろうが治療は行われているからです。
しかし米国では全国データベースの分析により、エストロゲン受容体(ER)レベルが低い早期乳がんを患う米国人の40%以上が内分泌療法を受けていなかったことが判明しています。5年10年と投薬を続け、処方を受けていれば治療費が高額な米国では負担も大きくなります。そうした影響もあるのかもしれません。
しかしER発現率が1~10%の女性において、内分泌療法の省略は3年間の死亡リスクの23%の上昇と関連していることが同時に明らかになっています(HR 1.23、95%信頼区間1.04~1.46)。
このリスク上昇の大部分は、ER発現率が6~10%の患者で占められていました。ちなみにわが国ではERが5%以上陽性であればまずホルモン剤は投与されていると思いますので安心してください。
そして術前化学治療の適応とされ、これを受けた患者のサブグループ解析では、術前化学治療を行っても病変が残存していた場合、内分泌療法を省略してしまうと全生存率(OS)が有意に不良であったことがわかっています。
今回の研究からは、術前に化学治療を行っても完全奏効に達しない、そして病変が残存していた患者が内分泌療法から恩恵を受ける可能性が最も高いことが示唆されました。術前に化学治療を受けた患者のサブグループにおいて、逆に病理学的完全奏効に達した患者では内分泌療法の省略がOSに有意な影響を与えませんでしたが(HR 1.06、95% CI 0.62-1.80)、残存病変が残った患者では間違いなく生存率が悪化しました(HR 1.26、95% CI 1.00-1.57、P =0.046)。
「理由はおそらくかなり単純です」とこの研究の責任者であるゲッツ先生は述べています。
「残存病変がある場合、ER陽性の腫瘍細胞が濃縮されている可能性が高いです。私たちはその点については調べませんでしたが、過去に他の研究者が調べています。私たちの推奨の一つは、化学療法後に乳房内に残存する腫瘍を再検査することです。」
実際 ER陽性細胞はホルモン剤が効果を発揮しますが、抗がん剤は効きにくい傾向があります。逆にER陰性細胞は抗がん剤しか効果がありませんが、効果はER陽性細胞より高い傾向があります。ですので、抗がん剤を施行して生き残ったがん細胞ではER陽性細胞がより濃縮されている可能性が高く、これをたたくにはホルモン剤を使用するしかないし、それを省略することは、ERの陽性率にかかわらず、危険であると考えられるのです。
したがって、ERが6-10%の乳がん患者さんではホルモン剤の使用はすべての方に勧められます。
特に術前化学治療を施行しても完全緩解が得られず、腫瘍が残存しており、その中にER陽性細胞が含まれていた患者さんでは、ホルモン剤の省略は非常に危険と考えるべきだと思われます。
あぁ、ついにその時代が来るのか…この結果をみて私はそう思いました。
毎年米国シカゴではASCO、米国の臨床腫瘍学会が巨大な会場で開催されます。世界中のがんの研究者が集まって、その研究成果を発表する、おそらく世界最大の学会です。今年は5月30日から開催です。
その会場では、エポックメイキングな、つまり今後の標準治療そのものを変えてしまうような、時代を変化させてしまう素晴らしい発表が何年かに一度なされます。その時その会場に居合わせた医師はラッキーです。
会場全体で医師が立ち上がり、地鳴りのような拍手でスタンディングオベーションが起こるのです。難しい英語で、発表の最中にはついていけなかったぺいぺいの医師であっても、その雰囲気ですごいことが起こったのだとわかります。その翌日、その日から、業界にニュースが知れ渡り始めます。そしてすべての医師が、これからは標準治療、つまりこれが最善であり、当たり前であり、これ以外の治療は何らかの理由がなければ選ばれることはない、そのスタンダードがはっきりと変わったことを知るのです。
この研究の結論が発表された時、おそらくその一つになるのでしょう。
前振りが長くなりました。
テキサス大学MDアンダーソンがんセンターの研究者による新しいデータによると、もともと早期乳がん患者でありながら、術前に化学療法を施行し、画像上にがんが確認できないくらいに小さくなってしまった、そしてそうした乳腺に標準的な放射線治療を行った場合、手術が必要ない可能性があるということがわかりました。
JAMA Oncology 誌に掲載された第2相試験、その5年間経過観察された結果によると、
早期がんで発見された乳腺のしこりに、手術を行うことなしに抗がん剤による化学療法と、その後に放射線療法を行い、針生検による組織学的検査を行います。そこで病理学的完全奏効、つまりがんが残っていない、と診断された患者では、そのまま手術なしで経過観察していても、乳がんが再発していないことが明らかになりました。
追跡期間中央値55.4か月(つまり約4年半は経過を見たということです)、病理学的完全奏効を示した31人の患者全員が無病状態を維持し、全生存率は100%だったとのことです。
抗がん剤をされる、これは手術をされなくてもいやでしょう。ただ手術をしても抗がん剤される方はいます。放射線治療は、乳腺を全摘せずに温存した方では絶対、全摘しても必要とされる方はいます。
この二つをして、その後にしこりがあった部位を特殊な針で突いて検査をします。
顕微鏡で見て、がんが残っていない、と判断されたら、もともとしこりが存在した部位を含めてすべてそのまま手術をせずに経過観察するわけです。
そうしたら4年以上経過観察して、再発もなく、乳がんで死亡する方も0だった。そういう結果です。
外科腫瘍学会2025年年次総会でも発表されたこの研究結果は、乳がん患者さんのうち、一部の患者では長い間標準治療の一部となってきた乳房手術を回避できる可能性があることを明らかに示唆しています。
「5年経過時点で乳がんの再発が認められなかったことは、この手術を伴わない乳がん管理法の大きな可能性を浮き彫りにしています」と、MDアンダーソンの乳腺外科腫瘍学教授で主任研究者のヘンリー・クーラー医学博士は述べました。
この研究は、化学療法に良好な反応を示す早期乳がん患者において、手術を省略することができるか、という疑問に関する初の近代的な手法による前向き試験です。約 2年間の追跡調査による結果は、以前 The Lancet Oncology 誌に発表されています。今回それが5年間に延長されました。
世界中で、毎年 230 万人の女性が乳がんと診断されています。1 世紀以上にわたり、末期がんではない、転移を伴わない浸潤性疾患の治療では手術が標準でした。しかし化学療法剤の改良により病理学的完全奏効率が大幅に向上しました。この高い奏効率と選択的画像誘導吸引補助コア生検(US-VABという検査方法です。これは病理検査のところで触れています)および厳格な組織学的処理を組み合わせることで、手術が必要ない患者を判別する医師の能力が向上しました。
この多施設共同試験には、早期段階のトリプルネガティブ乳がんまたは HER2 陽性乳がんを患う 40 歳以上の女性 50 名が参加しました。参加者の平均年齢は 62 歳で、トリプルネガティブ乳がん患者が 21 名、HER2 陽性乳がん患者が 29 名でした。
標準的な化学療法治療後に、この試験の参加者の乳腺のしこりが画像診断で確認され、そのすべてが 2 cm 未満と判定されました。その後 患者は 画像誘導吸引補助コア生検(US-VAB検査)を受けました。この生検で生きたがん細胞が認められなかった場合、手術は省略されます。
その後 患者は標準的な乳房放射線療法に進みました。
US-VAB生検では、病理学的完全奏効が確認されたのは、31 人の患者でした。
この多施設共同試験は患者数 100 名に拡大され、現在韓国でもさらに調査が進められています。
「これらの有望な結果が続いていることから、浸潤性乳がんに対する乳房手術をなくすことが新たな標準治療となり、今後は乳がんに罹患した女性に、乳房を温存し、体を傷つけずに済む機会を提供できることがあり得るようになる」とクエラー博士は述べました。
「この治療法が日常的なものになることを期待しているが、これが標準治療となるにはさらなる臨床試験が必要だ」
まとめ
トリプルネガティブ乳がんはともかく、HER2陽性乳がんはほぼ全例で抗がん剤が必要とされます。せっかく早期発見されても、抗がん剤を投与されることがおおいタイプになります。
どうせ抗がん剤されるのであれば、早期がんであればがんが画像上消失してしまうこともあるわけで、そういった場合、手術を省略できるのではないか、とはだれでも考える疑問です。
今回、こういう条件を満たせば手術を省略できる、という道しるべが提示されたことは大きい。今後はその検証も加速するでしょう。
あと5年、10年後には早期乳がんの標準治療の一つに、手術なしの治療法が加わることになることはほぼ確実です。
たとえば毎年ドックをしている、クーポン検診は2年ごとにすべて受けているなど、きちんきちんと検診をうけているのにその時には見つからず、結局自分でしこりに気が付いて見つかる乳がんがあります。それを中間期(検診と検診の中間)がんと呼びます。この中間期がんについて、このブログでも何度か述べてきました。
雨の乳がん学会総会 その2 中間期がん(検診と検診の間に見つかるがんという考え方)
検診を受けていれば大丈夫・・・なのか? さらに中間期がんについて
中間期がんは皆さんにとっては”検診の見落とし”として映ります。
乳がん検診の有効性に対する否定にもつながり、さらに医療そのものに対しても不信感を持つ原因にもなるでしょう。こうした皆さんの中に生じた疑惑は、医療行政にも影響を与え、結局検診なんてやっていても無駄だ、税金の無駄だ、という考えにつながります。中間期がんを無くすことは我々にとっても死活問題とも言えます。しかし決してなくなりません。
マンモグラフィ、乳腺超音波検査、これらを検診としてルーティンで施行している行政機関もあるでしょう。最近ではBRCA陽性症例では毎年のMRI検査を義務付けている施設もある。
しかし中間期がんはなくなっていません。
持っている道具、つまり検診の機器の性能が多少なりと改善したとしても、根本的に変わらないのであれば、検診の頻度を上げるしかありません。しかしそれも限界があるでしょう。毎月受ける、3か月に1回受ける・・・無理です。それはもう検診ではありません。1年に1回が乳がんに罹患したこともない、基本的に健康である皆さんにとって、生活の時間を割くことのできる限界ではないでしょうか。
だとすると中間期がんはなくならないでしょう。
それはこういうことから証明できます。
米国では、2年おきのマンモグラフィ検診を、毎年に変更したら、乳がんによる死亡をどれくらい下げることができるのか、調査されました。
検診を受けたことがない方が、乳がんで毎年亡くなっています。その数を100とします。
40歳から74歳まで2年おきにマンモグラフィ検診を施行します。するとその数は70までさがります。いえ、70までしか下がりません。
ではそれを40さいから74歳まで毎年に変更したとします。するとその数は0になるでしょうか?
いいえ、なりません。63に下がるだけです。63の方々は毎年マンモグラフィ検診を受けていても、受けていない方と同じく乳がんで亡くなってしまっています。
これは驚くべき数字です。
予算を倍に増やし、頻度を倍にしても、乳がんで亡くなる方は7%下がるだけなのです。もっといえば63%の方は検診を受けていてもいなくても、かわらず乳がんで亡くなってしまいます。
私はマンモグラフィ検診は、もともと皆さんの期待を10としても4、せいぜい5にしかならない検査とお話ししています。それはこういった結果によります。
検診に携わっている医師は、絶対に見落とさない、という覚悟のもと、日夜 勉強会、研究会と称してマンモグラフィの読影の研鑽に励んでいます。私もその一人ではあるのですが、こうして名人芸の域に達した読影医の先生がどれほど大量に出現したとしても、おそらく中間期がんは目に見えては減らないでしょう。それはこのマンモグラフィというモダリティがそもそもすべての乳がんが発見できる検査方法、検査機器ではないことがもう明らかなのではないか、と考えられるからです。中間期がんを無くすという課題は、見落としを防ぐ、という方向での努力では解決しないことはもはや明らかだと思います。(もちろん現状こうした努力を否定しているのではありませんよ。)
もしこの検診を受けながらも乳がんで亡くなってしまう63%の方々が、日常でしっかり自分で自己チェックされていたとしたら、中間期がんとして見つかった可能性があります。ただ、それが早期発見であったかどうかはこの資料からはわかりません。もちろん私はきちんとした方法で、正しく努力すれば自己チェックで早期発見は可能だと考えているからこそ、本を出したわけなのですが…。

さて この中間期がんですが、検診で発見される乳がんよりも予後が悪いことが明らかになっています。
高濃度乳腺に発生する乳がんは、中間期がんとなりやすいことはすでに述べました。
高濃度乳腺は出産経験のない方によく見られ、また20代、30代の若年者のほとんどが高濃度乳腺です。そうしたことを踏まえれば、中間期がんの予後が不良であることが多いことは理解ができます。
最新のJAMA Oncology に掲載された研究によると、何十年にもわたって年齢に基づいたマンモグラフィー検査が行われてきたにもかかわらず、スウェーデンの女性で発見された乳がんの30% が、驚くべきことに予定された検診の間に発見されていないことがわかっています。
これらの中間期がんを早期に発見するために、その女性個人ごとに個別化されたリスクに基づく検診戦略へ移行するべきではないか、という考え方が出てきています。
中間期がんは、定期検診と定期検診の間隙をぬって発見され、診断される乳がんです。マンモグラフィー検診は、乳がんを早期に発見し、死亡率を確実に低下させます。しかし定期検診で乳がんが発見されたとしても、乳がんの自然史を考えればたとえば2年前の検診の際には乳がんがまったく存在しなかったということは考えられず、残念ながらその前回、前々回の検診では多くの乳がんを見逃していたことは確実です。
高濃度乳腺、不均一高濃度乳腺と呼ばれる密度が高い乳房は、それだけで乳がんのリスクを高め、腫瘍を見えにくくしてマンモグラムの読影を複雑にするため、マンモグラフィーによる検診の精度を下げてしまいます。中間期がんの発生率についていまだ十分に調査されたとは言えませんが、画像技術、放射線科医の解釈、乳房密度などの患者固有の特性などの要因により、存在している乳がんがマンモグラフィ検診で検出されないことは実は珍しくはないのです。
先にも述べましたが、中間期がんは現状の医療レベルでは避けられません。しかしたとえば乳房密度がマンモグラフィに与える影響について、患者さんも医療提供者事態も理解が不足していることにより、中間期がんが発生するたび、検診への不信と、2 年ごとのスクリーニングの有効性についての疑問が生じてしまっています。
1989年から2020年の間にストックホルムのマンモグラフィ検診を受けたスウェーデン生まれの女性を対象に、人口ベースのコホート研究が実施されました。これらの40歳から74歳の女性は、18か月から24か月ごとにマンモグラフィ検診を受けていました。この研究では、中間期がんとしての乳がんと、検診で発見された乳がんを調査し、次にすべての乳がん症例を分析してリスク要因の推定しました。
この研究結果から、29,049 人の女性 (5.5%) が乳がんと診断され、そのうち 10,631 人 (2%) がスクリーニングで発見されたがん、4,369 人 (0.8%) が中間期がんとして診断されました。
中間期がんは、浸潤性、腫瘍が大きい、リンパ節転移がある、組織学的な異型度が高い、Ki-67 増殖指数が高いなどの傾向が見られ、エストロゲン受容体 (ER) 陰性、プロゲステロン受容体陰性、HER2陽性である割合も高いという結果でした。
乳がんと診断された患者さんの約 30% が中間期がんとして発症しました。この割合は患者の年齢が上がるにつれて減少していました。
中間期がんとして発見されるリスクが高い方は、初産年齢が高い、教育水準が高い、ホルモン補充療法 (HRT)を受けている、マンモグラフィが高濃度である、ことが関与していることがわかりました。
肥満とそれに関連する疾患は、検診で発見される乳がんのリスクを高めますが、中間期がんのリスクは低下していました。マンモグラフィの高濃度は、中間期がんのリスクを高めるのみならず、検診で発見されるがんなど、全ての乳がんのリスクと関連していました。
家族に乳がんの既往歴がある場合、中間期がんのリスクは 1.85 倍 (95% CI、1.72-1.99) 増加します。具体的には、中間期がんの家族歴があると HR は 2.92 倍(95% CI、2.39-3.55) に上昇し、スクリーニングでがんが発見された家族歴があると 1.70倍 (95% CI、1.44-2.01) に上昇します。
遺伝性乳がん卵巣がん 症候群(HBOC) の家族歴があると、中間期がんのリスクが大幅に増加します。
さらに、卵巣がん、大腸がん、前立腺がん、黒色腫、精巣がんの家族歴も、中間期がんのリスクを高めます。
中間期がんを発症した女性は、検診でがんが発見された女性と比較して、エストロゲンホルモンレセプター(ER)陰性がんを発症する確率が高く (22% 対 11%)、ER 陰性乳がんの家族歴があると、ER 陰性の中間期がんを発症するリスクが 3 倍になりました。
過去 30 年間、スウェーデンは中間期がんの割合を減らすことができず、研究者らは今回の検討により、中間期がんをより効果的に標的とできるリスク要因を特定しました。具体的には、乳腺密度が高く、ホルモン補充療法を受けている女性は中間期がんの見逃しが多く、その発生を減らすにはたとえば乳腺USを併用する、MRIを併用するなど、今までのマンモグラフィ検診だけにはとどまらない、検診感度の向上が必要でした。
2025.03.25
世界保健機関の世界乳がんイニシアチブ(GBCI)の新しいデータは、今後20年間で乳がんの診断数と死亡率が上昇する可能性が高いことを示しており、警告しています。
2021年に結成されたGBCIは、2040年までに世界の乳がんによる死亡者数を毎年2.5%削減するための枠組みを作るために設立されました。米国やHuman Development Indexの高い他の国々では死亡者数を減らすことに大きな進歩が見られてきましたが、GBCIの新しいデータは、これらの改善が世界の隅々まで均等に分配されてはいないことを示唆しています。(筆者注:Human Development Index(HDI、人間開発指数)とは、国連開発計画(UNDP)が発表する指標で、各国の人間の発展(Human Development)の度合いを測るためのものです。これは、単に経済的な豊かさだけでなく、健康や教育の観点からも総合的に国の発展を評価することを目的としています。)
専門家らは、世界185カ国を対象としたGLOBOCANデータベースのデータを用いて、乳がんの診断と死亡率の傾向を分析し、両者の今後10年および20年間の軌跡を推定してみました。
チームは、2050年までに新規症例が約38%増加し、死亡者数はさらに急激に増加し、世界全体で68%増加する可能性があると結論付けました。
これらの推定は、早期発見の取り組みが不足している低所得地域に不釣り合いなほど大きな影響を与えます。たとえば、メラネシア、ポリネシア、西アフリカでは死亡率が最も高くなると予測されていますが、東アジア(よかった、日本も入ります)、中央アメリカ、北アメリカでは死亡率が最も低くなると予想されています。
逆に、オーストラリア、ニュージーランド、北アメリカ、北ヨーロッパでは、診断率が最も高くなると予測されています。これは、これらの地域での早期発見の取り組みによるものと考えられます。つまり、より多くのがんが特定されることになりますが、がんが治療に反応しやすいより早い段階で発見される可能性が高くなります。
この報告書の調査結果は、10月に発表されたアメリカがん協会の年次乳がん統計で共有されたデータと一致しています。この報告書では、米国では乳がんによる死亡者数が1989年以降44%減少しているにもかかわらず、がん罹患率は数十年にわたって着実に上昇していることが明らかにされています。
前述の直後に発表された、データと分析の大手プロバイダーであるLexis Nexis Risk Solutionsからの追加データは、米国における新たな乳がんと診断される女性の増加という調査結果をさらに裏付けました。そしてこのレポートは、若い女性のがん診断が「憂慮すべき」割合で増加しているという新たな傾向を浮き彫りにしました。このレポートによると、30代の女性の乳がん罹患率は2021年から2023年の間に13%増加しました。
世界的にみると、乳がんの負担は 50 歳以上の女性の間で最も高くなっています。ただし、これらの数字は地域によっても異なります。たとえば、アフリカでは、乳がんの診断の 47% が 50 歳未満の女性で発生しています。比較すると、北米とヨーロッパでは、女性の 18% と 19% が 50 歳未満で診断されています。
これらの報告書はいずれも、若い女性のがん診断の増加は主にスクリーニングの増加によるものだとしています。新しいリスク評価モデルによって、より早期のスクリーニングが奨励されているからです。十分な診断リソースがないにもかかわらず、なぜ特定の地域で若い女性の診断率が高いのかを解明するには、地域別の追加調査が必要だが、この最新の報告書は、早期発見が死亡率低下の鍵であるという考えをさらに強調していると考えられます。
「2050年には乳がんの新規患者が320万人、乳がんによる死亡者が110万人に達すると予測されており、既知の修正可能なリスク要因への介入による一次予防を通じて負担を軽減することは可能ですが、そのためには協調的な努力と政治的意思が必要です」と報告書は述べています。
「乳がん生存率の不平等の拡大を減らし、今後数年間に乳がんと診断される数百万人の女性の予後不良を軽減するために、特にHDIの低い国と中程度の国では、早期診断と治療への継続的な投資と改善が緊急に必要です」と締めくくられています。
出展は「Nature medicine」です。
学者の文章とはこれほどわかりにくいか、という文章で申し訳ない。
簡単に要約すると、WHOの専門機関の調査結果によれば
1 世界的に乳がんに罹患し、死亡する女性は確実に増加傾向にある。
「2050年までに新規症例が約38%増加し、死亡者数はさらに急激に増加し、世界全体で68%増加する可能性がある。」
2 十分な対策が取られていない国では乳がんによる死亡率も当然増加するが、対策が取られている国では死亡率は低下している。
(この論文ではHuman Development Index(HDI、人間開発指数)の低い国という定義)
「米国では乳がんによる死亡者数が1989年以降44%減少しているにもかかわらず、がん罹患率は数十年にわたって着実に上昇している」
3 HDIの高い国では「若い女性のがん診断が「憂慮すべき」割合で増加している」が、それは若い女性に対してもリスクを評価し、スクリーニング(検診)をすることが普及しているからだろうと考えられる。
4 こうした取り組みが、今後の乳がん罹患率の上昇に対応するためには非常に重要になることが明らかになった。
先日 Youtubeを見ていて、恐ろしいことを述べている投稿に目が留まりました。
その内容というのは、
1 米国では40歳以下のマンモグラフィ検査は”禁止”されており、施行すれば逮捕される。
2 それくらい被ばく量の多い検査であり、大変危険な検査である。
3 最近になって乳がんが異常に増加している原因、それはマンモグラフィ検診の普及によるものなのだ。
こんな恐ろしいことをいう方がいるのか、と正直震えました。
全て”うそ”です。
まず私のブログを読んでおられる方であれば1については理解できると思います。
40歳以下(未満ですが)に施行しない、75歳以上に施行しないのは、「施行による死亡率の減少効果が認められなかったから」です。つまりやっても意味がないからしないのであって、禁止もされていなければ、逮捕もされません。事実、米国では25歳以上の女性には、乳がんのリスク評価を行い、必要であれば施行する制度ができています。被ばくが問題ではない、とは言いませんが、被ばくというデメリットと(というよりもコストや時間、乳がんでもないのに乳がんの疑いとされて精査をされる偽陽性の存在などのデメリットを強調していますが)、乳がん死の減少というメリットのバランスが40歳以下では取れていないのでしない、ということなのです。これについては何度もここで触れてきました。
米国予防サービスタスクフォース(USPSTF)が乳癌検診に関する新しい草案勧告を発表しました。
最近、医師がYoutuberとしてSNSに参戦し、その専門知識を使ってさまざまなコンテンツをアップロードしていますが、さすがに自分の医師免許をアップロードしているところは見たことがありません。そのYoutuberがコンテンツの中で自身が医療に携わっていると言っているだけです。証明はされていません。さすがに偽医師はいないでしょうが…
Youtubeは規制がほぼなく、コンプライアンスが既存のメディアに比べて緩いことが魅力でもありますが、少なくとも医療に関することを、資格のない方が一般の方に影響を及ぼす形で発信していることには問題があるように思います。特にこうしたSNSコンテンツではインパクトがないと再生してもらえないため、サムネと言われる”表紙”で衝撃的な内容を書いておいて、中身を見ると違うことを言っていることもよくあります。今回はしかしその通りの内容だったので驚きました。ほぼすべてうそを本当らしく事実と絡めながら述べていました。
2のマンモグラフィの被ばく量について改めて解説します。
1. マンモグラフィ検査: 被ばく量:0.1~0.5 mSv(ミリシーベルトと読みます)
特徴:乳房に対するX線撮影で、低エネルギーのX線を使用。
乳がんの早期発見に有効。被ばく量は比較的少ない。
2. 胸部X線写真(一般撮影):被ばく量:0.02~0.1 mSv(通常は約 0.05 mSv)
特徴:肺や心臓の状態を評価するための一般的な検査。
被ばく量は非常に少なく、通常の生活で受ける自然放射線(年間約2.4 mSv)のごく一部。
3. CT検査
被ばく量:胸部CT:5~7 mSv
被ばく量:腹部CT:8~10 mSv
被ばく量:頭部CT:2~4 mSv
全身CT(フルボディスキャン):20~30 mSv
特徴:X線を用いた断層撮影で、詳細な画像を取得可能。
一般撮影より被ばく量が多いが、診断価値が高い。
4. PET検査(PET-CT):被ばく量:5~25 mSv(PET単体:約5 mSv、PET-CT:約10~25 mSv)
特徴:放射性薬剤(18F-FDG など)を体内に注射し、がんや炎症などを検出。
CTと組み合わせたPET-CTでは被ばく量が増加。
まとめ
胸部X線やマンモグラフィは被ばく量が少なく、安全性が高い。
CT検査は部位によるが、胸部・腹部CTは比較的高い被ばく量になる。
PET-CTは放射性薬剤とCTを併用するため、被ばく量が高くなる。
これでわかるように、マンモグラフィの被ばく量は決して高くありません。胸部X線と比較すれば高く感じますが、胸部X線検査は1枚で終わりです。受けたことがある方は知っていると思いますが、マンモグラフィでは右側で2枚、左側で2枚とることもあるので、その分高くなります。ただ当然乳腺だけにできるだけあたるように絞って行われているので、左右別々に取る必要があるのです。CTではそんなことはしませんよね。
ちなみにミリシーベルトという単位について少し解説します。
ミリの部分は1mシーベルトは、1シーベルトの千分の1という意味になります。
シーベルト(Sv)は、放射線が人体に与える影響(生物学的影響)を評価するための単位です。
1. 放射線の基本単位
放射線に関する単位には以下の3つがあります。
グレイ(Gy) は「1 kgの物質が何ジュールの放射線エネルギーを吸収したか」を示します。
シーベルト(Sv) は「放射線の種類と人体への影響を考慮した線量」です。
1 Gy = 1 Sv ではなく、放射線の種類によって異なります。
ベクレル(Bq) は「1秒間に何個の原子が崩壊し、放射線を出すか」を示す単位です。
このようにシーベルトは、人体への影響を評価するために使われ、以下の基準があります。
| 被ばく量(mSv) | 影響 |
|---|---|
| 0.05 | 胸部X線1回の被ばく |
| 1 |
年間の一般公衆の被ばく限度(人工放射線) |
| 2.4 | 世界の自然放射線の年間平均 |
| 10 | CT検査(腹部)の被ばく量 |
| 100 | がん発生リスクが増加する可能性があるレベル |
| 1000(1Sv) | 急性被ばくで一時的な白血球減少 |
| 4000(4Sv) | 50%の人が死亡する可能性(致死線量) |
このようにシーベルト(Sv)という単位は被ばくの影響を表す単位であり、1Sv浴びればその場で強い悪影響があります。治療で1Svも浴びることはあり得ないので、ミリつまりその1000分の1の単位で被ばく量を表します。マンモグラフィは高く見積もっても0.5mSvですから、生活しているだけで環境から浴びてしまう自然放射線量の1/5程度ということになります。私がみたYoutubeコンテンツでは胸部X線写真と比較していましたが、胸部X線検査は検診だけでなく、肺炎や気管支炎などの診断や、治療効果の判定にも使います。1週間で3-4回施行することもある。撮影する対象も違いますし、目的も違う。比較することが根本的におかしい。
大袈裟に見えるようにあえて被ばく量のもっとも少ない検査をもってきて、比較してみせているだけのように思いました。

最後に、「最近になって乳がんが異常に増加している原因、それはマンモグラフィ検診の普及によるものなのだ」の部分です。これが最も劇的で、逆説的で、そして都市伝説的で、目を引く文章になると思います。しかしこれが完全に嘘なのです。
まず乳がんが異常に増加しているのは、”最近”と書かれていますが、これはいつからのことを”最近”と言っているのでしょうか。
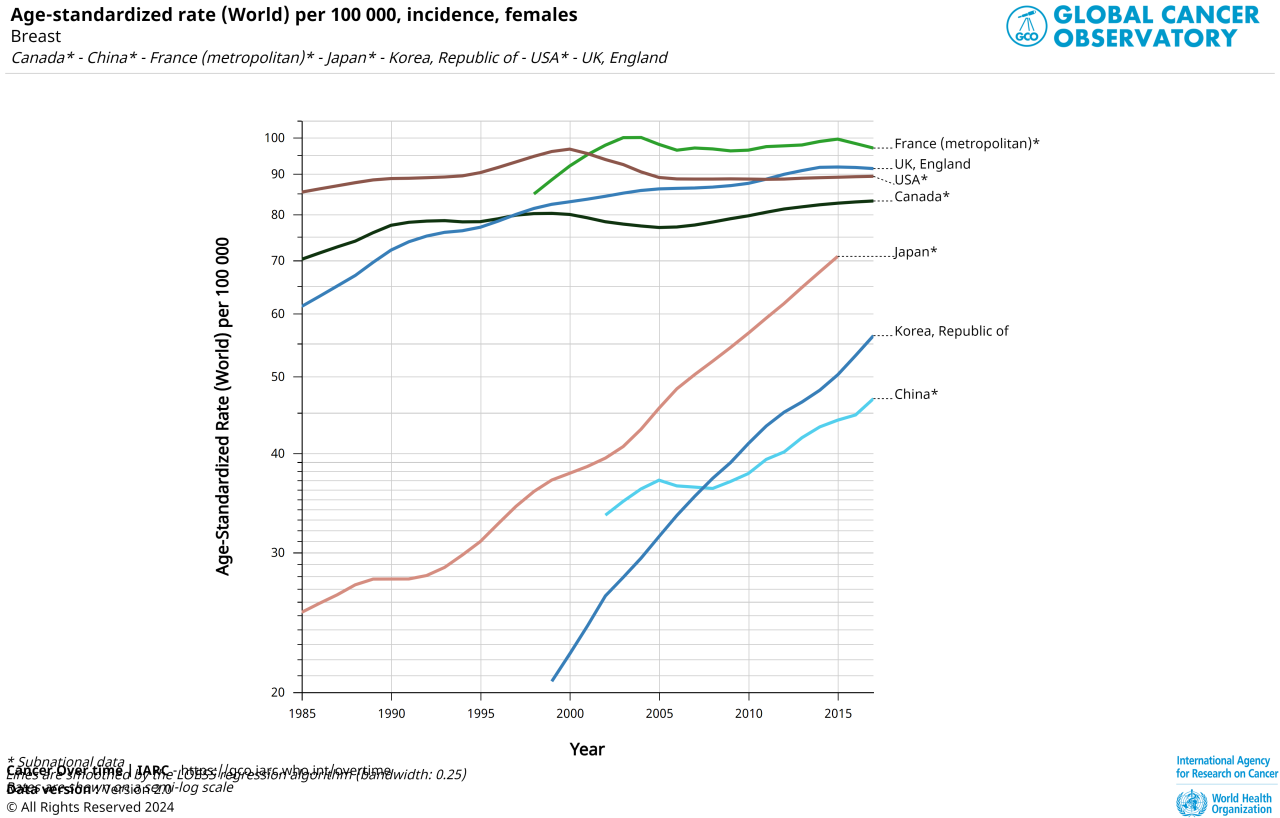
上記のグラフはWHOで公表されている人口10万人当たりの乳がんの罹患率の推移を示したグラフです。わが国の罹患率は下から3番目、急激に右肩上がりのオレンジ色ですが、ほぼずっと上昇傾向です。
上で固まっている中のえんじ色がアメリカ、濃緑がカナダです。
マンモグラフィ検診の日本での導入時期は1999年(本格導入)です。1980年代から試験的に導入されていましたが、正式な「対策型検診」として採用されたのは1999年です。2000年に厚生労働省が「乳がん検診指針」を改訂し、40歳以上の女性に対して2年に1回のマンモグラフィ検診を推奨したのが始まりです。
アメリカ(米国)では導入時期は1970年代~1980年代(普及)です。1960年代後半からマンモグラフィの技術が発展し、1970年代には一部で乳がん検診に活用されるようになりました。1980年代に入ると全米で本格的に普及し、1989年には米国予防医学タスクフォース(USPSTF)が推奨を始めています。カナダでは1988年に全国プログラム開始で導入されています。
グラフでわかりますが、日本での乳がん罹患率は検診が始まる1999年より前から上昇しています。
またマンモグラフィ検診が原因なら米国や、カナダで同じような上昇が認められ、それが10-20年前倒しで起こるはずですが、それは認められていません。
乳がん罹患率が上昇しているからマンモグラフィ検診が導入されたのです。それを逆に解釈するのはあまりにも悪意に満ちたひどい解釈です。
ではなぜ乳がんがこれほど増加しているのか、それも私のブログの中で触れています。もちろん一つの要因で説明できないことはあるでしょうが、この説は京都大学の研究で裏付けられたものです。よかったらこちらも参考にしてください。
なぜ乳がんは増えているのか ついに学問的に説明できてしまった?
コロナワクチン以来、陰謀説の花盛りの時代です。いつの間にか根拠のないうわさが独り歩きし、時に誤った認識を広めることでうわさが害をなすこともあります。皆さんも、オールドもニューも、メディアのいうことをうのみにせず、自分で判断する目を養ってください。
それは私のブログに関しても同様ですけれどもね。
2025.03.14
乳がんに限ったことにはありませんが、がんの治療法は進化し続けており、常に新しい薬剤が開発され、時に画期的な発見によって、がんによる死亡率は年々減少し続けています。もちろんその進歩は止まることなく続いており、がん克服に向けて、世界中で優秀な医師、研究者が画期的な治療法や、薬剤を求めて日夜努力を続けています。
しかし乳がんに関しては、2010年ごろを契機にして、なぜかその傾向が止まってしまっており、とくに40歳未満および74歳以上の女性の乳がんによる死亡率が、それまでは長期にわたって減少していたにもかかわらず、低下が止まっていることが研究によってわかっています。
20歳から39歳の女性の乳がん死亡率は、1990年から2010年にかけて年間2.8%減少していました。しかし2010年から2022年にかけては減少が見られず、年間変化率は-0.01(P =0.98)と、ほぼ全く変化しなくなっている、と、テキサス州テンプルのベイラー・スコット&ホワイト・セントラル・テキサス画像研究教育財団の医学博士デブラ・L・モンティチオロ氏と、コロラド州オーロラのコロラド大学アンシュッツ医学部のR・エドワード・ヘンドリック博士が報告しました。
そして75歳以上の女性では、乳がんによる死亡率は1993年から2013年にかけて大幅に減少していました(年間変化率 -1.26、P =0.01)が、2013年から2022年にかけては減少の証拠は見られませんでした(APC -0.2、P =0.24)と、最新のJournal of Breast Imaging誌で指摘されています。
40歳、74歳という年齢におけるキーポイントがあるように見えます。これは米国の予防サービスタスクフォースと呼ばれる国の定めた委員会が、「マンモグラフィによる乳がん検診の対象年齢を40歳から74歳まで、隔年での施行を勧める」としたことに起因します。(参照)
研究者たちは、年齢制限を書けることの愚かさを、根拠を示してこのガイドラインに反対しようとしている、ということを背景として知っておくとより理解が深まるでしょう。
しかし、40歳から74歳の女性(つまりマンモグラフィ検診の対象年齢)の場合、乳がんによる死亡率は1990年から2022年にかけて年間1.7%から3.9%減少しており(P <0.001)、この年齢層ではアジア人女性を除くすべてのコホート研究で乳がん死の減少が観察されました。つまりこの年齢層では死亡率の現象は現在まで継続しています。
1990年以降乳がん死亡率が低下し始めたのは、マンモグラフィーによる検診の普及と、治療法の改善によるものと思われます。
米国予防医学タスクフォースが推奨するスクリーニング範囲である40~74歳から漏れてしまっている年齢層の女性では、長年改善が見られてきた乳がん死亡率が、もはや低下していないことが懸念される、と研究者らは記しています。これらの年齢層で進行期乳がんの診断率が上昇しているため、死亡率の低下が止まった可能性があると指摘しました。
(筆者注)恐ろしいのは40歳以下の若年層、74歳以上の高齢者層で、進行がんで見つかる割合が”増えている”傾向が認められているということです。我が国日本では推奨年齢は40歳から60歳のままなので、もしそれが事実なら60歳以上の女性で同じ現象が起こっている可能性があります。
今回の分析では、研究者たちは、1990年から2022年までの全女性、年齢層別、人種または民族別の国立健康統計センターのデータを使用しました。この期間に女性全体で乳がん死亡率は43.5%減少し、年間変化率は1990年から2010年にかけて年間1.66%から3.28%減少しました。しかし、2010年から2022年にかけては年間1.23%の減少にまで縮小しました。
(筆者注:ちなみにわが国では乳がんの死亡率は減少傾向は未だ認められていません:WHO参照)
人種や民族別に見ても、ほとんどのグループで1990年から2022年にかけて乳がんによる死亡率が低下していました。観察期間中に乳がんによる死亡率は、白人女性の割合は41.4%、ヒスパニック系女性の割合は30.3%、黒人女性の割合は28.8%、アジア系女性の割合は11.8%減少していましたが、ネイティブアメリカン女性の割合のみ10.1%増加しました。
しかし、最近に絞ってこの傾向を調べてみると、乳がんによる死亡率は、アジア系女性では 2009 年以降、ヒスパニック系女性では 2008 年以降、ネイティブ アメリカン女性では 2005 年以降、低下が止まっていました。さらに、75 歳以上のアジア系女性の死亡率は 2004 年以降上昇しており、年間変化率は 0.73% です。
筆者注:米国では高等教育で自己チェックの指導を行っています。確かに小学生や中学生の年齢層に乳腺の自己チェックの教育をしてもピンと来ないかもしれません。しかし社会の貧困層に属している女性ほど高等教育を受ける機会に恵まれておらず、よって学校からも、またそうした教育を受けていない親からも、乳腺の自己チェックの習慣づけがなされていない可能性が高くなります。
ここではそこまで触れられていませんが、私は、人種による遺伝的素因よりもこうした社会的背景の影響の方が大きいと考えています。
そしてそこから鑑みるに、高等教育においても乳腺の自己チェックを指導しておらず、親世代も現代の若年世代も、自己チェックの教育を受ける機会が全くない日本人では、特に40歳以下、60歳以上で乳がんによる死亡率が減少しないどころか上昇していることが予想に硬くありません。
勤勉で、言われたことはきちんと守り、継続できる我が国の女性たちがなぜ乳がんで苦しまなければならないのか。私は憤りすら覚えます。
1990 年代前半から中頃にかけて、白人女性と黒人女性の両方で死亡率が全年齢層で大幅に低下し、黒人女性の 年間変化率は -1.42、白人女性の年間変化率 は -1.05 でした。
しかし、乳がんによる死亡率は黒人女性の方が白人女性よりも高く、その比率は年齢によって異なります。2004年から2022年まで、黒人女性と白人女性の乳がんによる死亡率の比率は全年齢で1.39で(筆者注 つまり同じ乳がんに罹患しても、黒人は白人の1.39倍亡くなっています)、年齢層によって大きく異なります。20~39歳の女性では2.04、40~74歳の女性では1.51、75歳以上の女性では1.13です。
40歳未満の女性の間での人種間での死亡率の差は、「特に若い黒人女性では、現在の乳がんリスク評価、検査、治療戦略を変更しなければならない」ことを示唆していると研究者たちは指摘しました。著者らはまた、診察時の黒人女性と白人女性との比較でステージIVの疾患発生率を評価し、黒人女性と白人女性のステージIVの発生率比が死亡率比を反映していることを発見しました。(筆者注:つまり末期がん状態で発見される割合が、黒人の若年者女性では高いわけです。)
だから25歳から40歳の女性全てが乳がん検診をするべきと考えているのではありません。乳がんのリスク評価は25歳までにすべての女性に推奨されています(筆者注:日本ではそれを受けることができる窓口はありません。それもまた我が国の恥ずかしいところです)。40歳未満の女性の乳がん検診は、その評価において平均以上のリスクがある場合にのみ推奨されます、と筆者は述べています。
「私たちの研究結果は、若い黒人女性がよりタイムリーなリスク評価と診断を受けられるようにするために、さらなる取り組みが必要であることを示唆している」と研究者らは記しています。「特に少数民族については、医療格差を考慮する必要があります」と結んでいました。
筆者から: わが国ではまずマンモグラフィ検診が40歳から60歳までに推奨されています。しかし40歳より若い年齢に乳がんが発生しないわけではありませんし、60歳以上の女性においてはむしろ40-60歳女性よりも多く乳がんが発生しています。当然74歳まで検診を推奨している米国よりも乳がんによる死亡率は高くなることは予想に硬くありません。
40歳以下、60歳以上の方は、したがって自己チェックをしておくことが必須になります。自発的にマンモグラフィ検診をドックなどで受けられてもいいですが、きちんと定期的に受けられていなければ危険性は低下しません。米国では25歳以上の方は自分の乳がんのリスクをチェックしてくれる窓口があります。リスクが低い方では40歳以下でマンモグラフィ検診を受けることは推奨されていません。しかし残念ながらそれを相談できる窓口が日本では存在しません。そして高齢の方ではなかなか医療機関の受診が難しい方もおられる。これらの若年者、高齢者こそ、何も害がなく、どこでもできる乳腺の自己チェックを徹底するべきです。
しかしそれに必要な知識、つまり自己チェックの教育がわが国ではなされていない、という現状があります。残念ながら学校や行政にそれを期待できない現状がわが国にはあります。
私は、たとえばこのコラムを読んでおられる知識のある方、検診を受けておられる世代、そうした方が若い娘、高齢の親に声掛けし、乳腺の自己チェックを指導していくしかない、と考えています。
2025.03.06
本の内容について、少しずつ触れてきました。
あまりしつこいと、よほど売りたいのかなと思われてしまう、と思っていたのですが、「大事なことなので一度しか言いませんよ、という人よりも、何度でも繰り返し言います、という人の方が信用できる」という記事をFACEBOOKで見ました。勇気をもらってもう少し話します。
本当に売りたいのなら、あまり内容を話さないほうが本来いいはずですものね。私は本にして出すほど、もともとしつこい人間もありますし(笑)。
前回も書きましたが、当クリニックで発見される乳がんの内約半数は定期的に検診されていて、我々が「今回は異常がみとめられます」と言って発見します。もちろんその場合はほぼ早期で発見されます。最終的にがんである診断には医師による病理検査が必要なので、全ての乳がん症例がわれわれによって診断が決定しているのは確かです。ただ残りの半数の方は「先生、なにか硬いしこりがあるんです。痛くもかゆくもないんですが…」といって来院され、われわれが検査をして、乳がんの診断がつきます。この場合、発見したのは我々ではなく、やはりご自身です。そして現状ではほぼすべての施設で発見されている乳がん症例のほぼ半分は、残念ながら検診ではなくこうして自分で発見されたものなのです。
ただ当然ですがそうして発見された乳がん症例では原則早期がんから、残念ながら末期で発見されるものまですべてが含まれることになります。それはご自身がどれだけ注意して自己チェックしていたか、そして発見してどれくらいの期間経過を見ていたか、に左右されます。
注意して定期的にきちんと自己チェックしていた方ほど、より小さく、早期で発見されます。
逆に普段全く意識をしておらず、入浴時や下着をつけていて偶然気付きました、という方であれば残念ながら早期がんではない確率が上昇します。まして、別に痛くもかゆくもないので、という理由で放置され、数か月経過を見ていて大きくなってきたので慌てて受診した、そういった乳がんでは残念ながら早期で収まっていることは期待できないでしょう。
私は2年に1度 クーポンできちんとマンモグラフィで検診を受けています!
たしかにそれは大切だし、早期発見につながります。けれども2年に1回しか検診をしていない、とも言えます。きちんと日を決めて、正しいやり方で自己チェックをしています、と言われる方は毎月検診をしています。
もちろん両方をされているのが最善です。
単純な比較はできませんが、検診に携わっている人間である私にとって、この2つの乳がん検診を比較し、どちらかを選べ、と言われれば後者の方が優れています。
2年に1度の検診は、もしその年に住み慣れない土地に引っ越したりして、受ける機会を逸してしまえば4年開いてしまいます。万が一そこで乳がんが発生すればまず早期発見などできないでしょう。
しかし毎月自己チェックを習慣にされている方ではそれがない。入浴を4年もしない方はいないと思われるからです。もちろんたとえ入浴できなくても自己チェックはできます。どこでもいつでもできるからです。どんなに仕事が忙しくても、育児が大変でも、妊娠されていても、高齢で動けなくても、医療施設のない島や田舎住まいの方でも、災害にあわれて避難生活を余儀なくされておられる方でも思い出しさえすればできるからです。もちろん1円たりとかかりません。それでいて早期に発見された場合の治療にかかる経済効果は計り知れません。
習慣にしてしまえばこれほど頼りになる検診はないのです。また自分でチェックできるのがほかのがんにはない乳がんだけの強みでもあります。


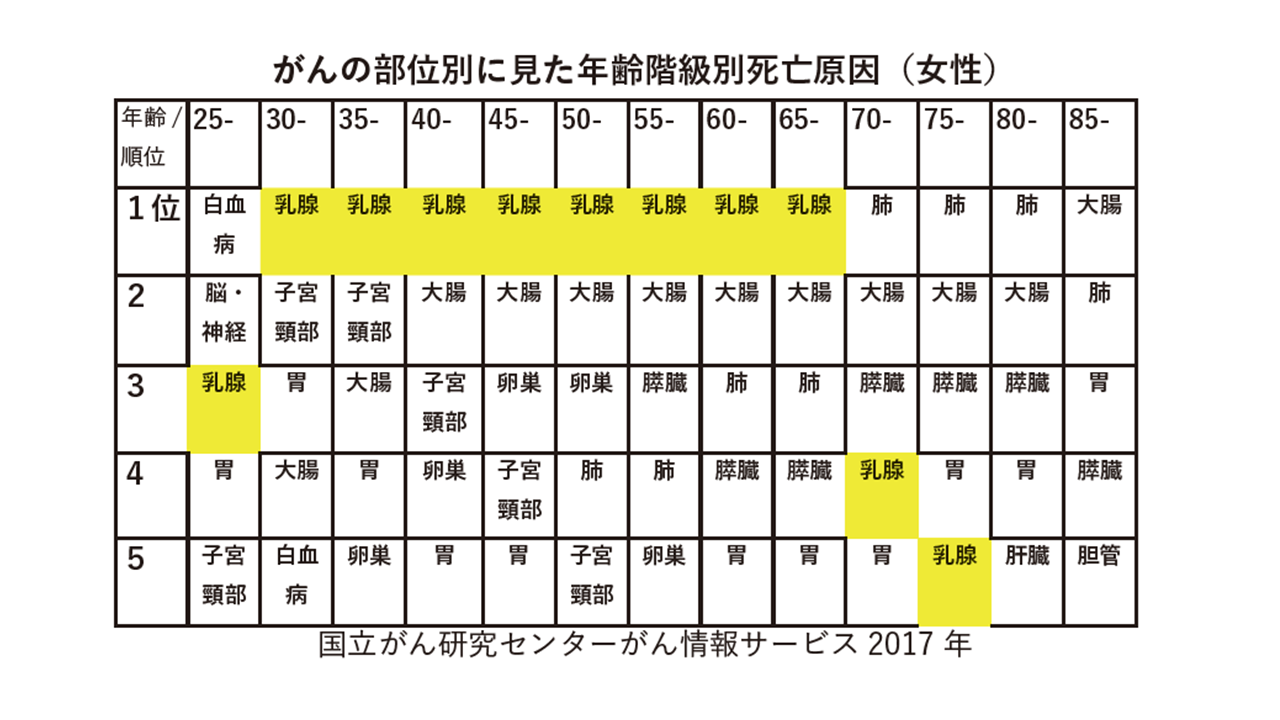
上の表は 日本の女性のがんによる死亡原因を年齢階級別にみたものです。
日本人女性のがんによる死亡原因で一番多いのは大腸がんであることはよく知られていますが、それは全体で高齢者を含めてみたときにそうなります。少なくとも30歳から70歳までの比較的若い女性で見たときには、死因の第1位は乳がんになります。
子宮頸がんは若い女性、特に20台30台では脅威です。しかしそれでも乳腺の方が上になります。
繰り返しますが、上の表は死因であり、罹患ではありません。がんになられ、亡くなっておられる方の順位を見たものです。少なくとも30歳代では乳がんは紛れもなくもっとも恐ろしいがんなのです。
そこで考えてほしいことがあります。
20歳代、30歳代でも確実に乳がんの方はおられます。そして不幸にして発見が遅れ、亡くなっておられる方もおられる。
20歳代、30歳代の方にはクーポンは来ません。ドックもまずいかないでしょう。
職場の検診のマンモグラフィも40歳からがほとんどですよね。
ではこうした若年齢者の乳がんはどうやって見つかっているのでしょう?
そう、自分で見つけているのです。自分で触っていて気づくしかない。
たしかに検診を受ければ、人間ドックを受ければ、早期で見つかるかもしれません。ただ検診は有料です。原則保険が効きません。20歳から毎年、規則正しく、お金を払って検診を受ける。気持ちがいいものでもないマンモグラフィ検査を受ける。ご自身に照らし合わせてください。まずやらないでしょう。
ではここで質問です。
小さいころからお風呂でお母さんが乳腺の自己チェックをしているのを見ている娘さん。お風呂にビー玉を置いてお母さんがチェックしていたら、娘さんなら必ず聞くはずです。
「お母さん、なにしているの?これなあに?」
これはね、乳がんのチェックをしているのよ。
「お母さん わたしは?」
いまはいいよ。でも大きくなったら必ずするようにしてね。
そうして育てられ、生理が始まったら自己チェックを習慣づけるように母親から言われて育った娘さん。
お母さんが自己チェックはもちろん、乳がんの検診などしていない。だから娘に声掛けなどしたこともない。注意もしない。そうしたお母さんに育てられた娘さん。
この二人の娘さんが不幸にして20歳代、30歳代で乳がんに罹患してしまったとしたら、発見が遅れて不幸な結果になる可能性が高いのはどちらの娘さんでしょうか?
これは聞くまでもない。そんなの分かり切ったことです。それを裏を返すと、こうした若年性乳がんで、残念ながら早期発見できなかったとしたら、不幸な顛末になってしまったとしたら、それは”親の責任”ということもできる。検診の対象にならない若い女性に、普段から、若い時から自己チェックをするように声掛けできるのは親だけだと思います。日常生活の場面場面で気を付けるように、たとえうるさがられても、言い続けることができるのも親だけだと思います。
その気持ちはある。ただどう教えたらいいかわからない。正しい方法がわからない。
だからこの本を書きました。
この本は、母へ娘へという副題がついています。これは、母へ(このことをわかってください。貴方だけが検診していてもだめだ、貴方の娘さんは大丈夫ですか)、(あなたの)娘へ(この本の内容を教えてください。検診に行かないまでも、定期的に正しく自己チェックをするように指導してください)という内容を込めているのです。

ご購入はここからどうぞ。別途送料がかかります。
歯磨きは親が子に教えて習慣にするもの、歯科検診は自分で考えていくようになるもの、です。
同様に 自己チェックは親が子に教えて習慣にするもの、クーポンをはじめとするマンモグラフィ検診や人間ドックは自分で考えていくようになるもの、です。
乳腺の自己チェックはしたがってすべての女性が日常で習慣としてするものです。
私の外来では、検診で来てくださった方の診察の中ではもちろん、待合室では私のビデオが流れていますし、このブログでも繰り返し、自己チェックをしてくださいとお願いしています。
ただ歯科検診を受診して、口頭で歯磨きをしてくださいね、とは声掛けしていただけると思いますが、正しい歯の磨き方を手取り足取り指導してくださる歯科医の先生はあまりおられないと思います。基本的に年に1,2回の指導では子供はきちんと磨くようにはなりません。やはり親の監視と指導があってはじめて習慣になります。しかも親に言われてやっているうちは本当の習慣ではありませんよね。自分からやるようになって初めて虫歯ができにくい環境が整います。歯磨きの指導は本来歯科医の日常の役割とは異なるのです。
私は乳腺の自己チェックもそれと同じで、乳がんの検診に自発的に来院されている女性に勧めていけば、きっと娘さんにも指導してくださるようになる、と考えています。それが今度は娘から孫に指導されるようになれば医師の役割は本来の役割に戻るでしょう。
ただ題名にあるように 「乳がんって自分で触っていたら本当にみつかるの?」という根本に疑問があれば、積極的にしようとは思ってくれないと思います。ただこの質問はあまりにも現状がわかっておられない質問なのです。
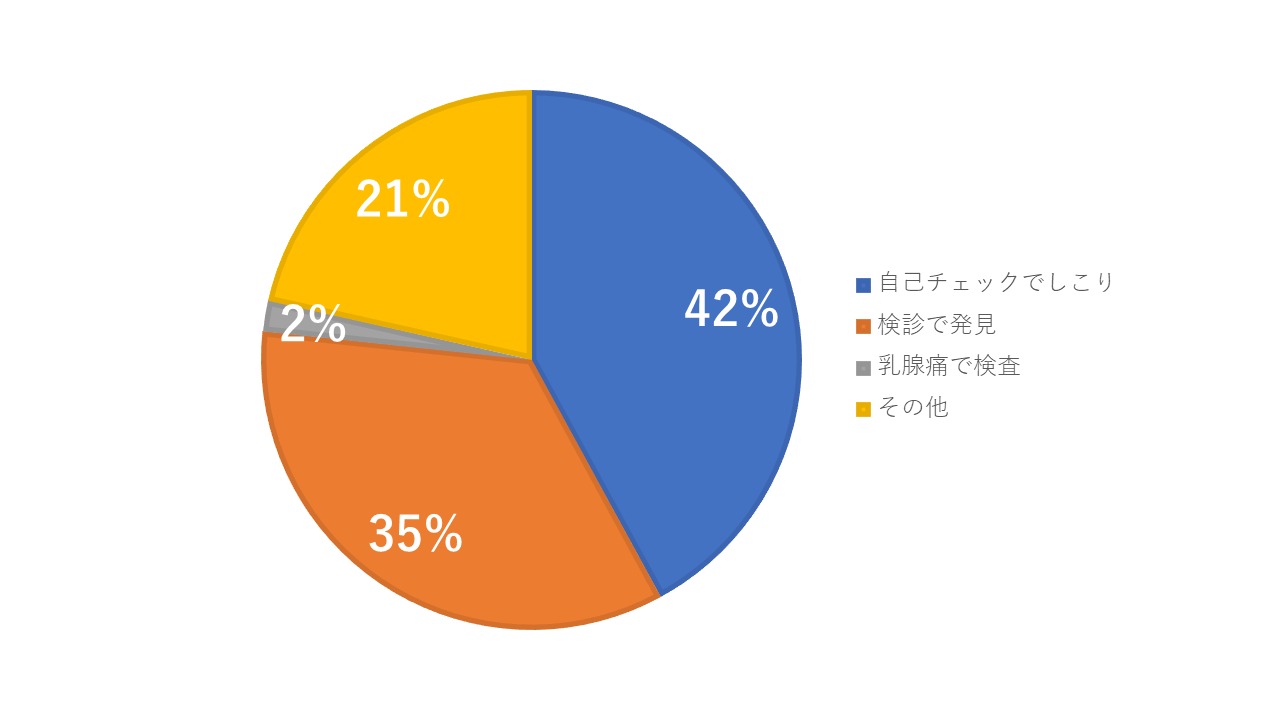
私の施設は年間2万人を検診し、大体200人強の乳がんを発見しています。
上の図はその内訳なのですが、昨年の段階でも残念ながら定期的に検診をされていて見つかった、あるいは他施設のドックや、クーポン検診で異常を指摘されて見つかった、そうした検診で発見された患者さんは35%です。割合から見て、最も多いのは自分で乳腺のしこりに気が付いて受診された、方です。
これはずっと変わりません。自己チェックでの発見はずっと1位で検診発見は2位です。すこしづつ2位が1位を追い上げていますが、まだ変わりません。
乳がんは自分で触って気がつくのですか?
「はい 乳がんの大部分は検診で見つかったのではなくて、自分で見つけられています。」
それが回答になります。

上の写真は、私の外来診察室においてある大小のビー玉と、ゴルフボールです。
右端の1.7㎝のビー玉が、私の本に付属しているものと同じサイズです。
「先生、乳がんって触っていたら本当にわかるんですか?」
これ(1.7cm)、自分の乳腺に当てて、想像してみてください。もしこの大きさで、この硬さのしこりが自分の乳腺に隠れていたら気づきますか?
「うーーん。難しいかな・・・」
そうですか?ではこの大きいビー玉(2.5cm)ならどうですか?
「いやこれは気づくでしょ。私の胸はそんなに大きくないし。」
そうですか?たとえば若い方が生理中や、生理前の乳腺が張って、痛みがあるような時ならどうでしょう?
「うーーん。そうですね・・・難しいかな。」
そう、だから自己チェックは痛みが気になったり、乳腺が張った時にするのではなくて、生理の間の乳腺が柔らかくて、張っていないときにしないといけません。娘さんに指導するときはそうしてください。ではこのゴルフボールならどうですか?
「これは論外ですよ。気づかない人いるんですか。」
そのとおり、乳がんを触って気が付かない人なんていないんですよ。乳がんに限らず、がんは必ず時間とともに進行して大きくなりますから。ただ、どの段階で気づくのか、それをできるだけ小さく見つけないといけないのです。自分で気づくにしても、検診で発見するにしても、早期で発見することが最も重要になります。自己チェックで気づくなら、この一番小さなビー玉が早期乳がんの上限になるのです。
できるだけ小さく見つけたい、小さい段階で気づきたい。
そのためには先に述べた生理前、生理中は避ける、など様々な注意があります。
自己チェックを行うのであれば、正しくやらなければどうしても発見が遅れるのです。逆に正しくやれば早期で発見することも可能になります。自己発見で見つかった乳がん患者さんでも、私のデータでは44%が早期発見されていました。
だからきちんとした知識を持って自己チェックをしなければなりません。
繰り返しになりますが、乳腺の自己チェックはすべての女性が、正しいやり方で規則正しく日常で習慣としてするものです。
そして自己チェックは親が子に正しいやり方を教えて正しく習慣にするもの、クーポンをはじめとするマンモグラフィ検診や人間ドックは自分で考えていくようになるもの、なのです。
前回の 自己チェックの”ポイント”を参考にしてください。ここで書いたことも本にまとめて書いています。よかったらご購入ください。
ご予約専用ダイヤル
079-283-6103